RNAs skjulte potentiale:Ny undersøgelse afslører sin rolle i det tidlige liv og fremtidig bioteknologi
Livets begyndelse på Jorden og dets udvikling over milliarder af år fortsætter med at fascinere forskere verden over. Det centrale dogme eller den retningsbestemte strøm af genetisk information fra en deoxyribosenukleinsyreskabelon (DNA) til et ribosenukleinsyretranskript (RNA) og endelig til et funktionelt protein, er grundlæggende for cellulær struktur og funktioner.
DNA fungerer som cellens blueprint og bærer genetisk information, der kræves til syntesen af funktionelle proteiner. Omvendt kræves proteiner til syntesen af DNA. Derfor, om DNA dukkede op først eller protein, er fortsat et spørgsmål om debat.
Denne molekylære version af "kylling og æg"-spørgsmålet førte til forslaget om en "RNA-verden." RNA'er i form af "ribozymer" eller RNA-enzymer bærer genetisk information, der ligner DNA og har også katalytiske funktioner som proteiner.
Opdagelsen af ribozymer gav yderligere næring til RNA World-hypotesen, hvor RNA tjente dobbelte funktioner som "genetisk informationslagring" og "katalyse", hvilket lette primitive livsaktiviteter udelukkende af RNA. Mens moderne ribosomer er et kompleks af RNA'er og proteiner, kan ribozymer under tidlige evolutionære stadier være blevet sat sammen gennem samlingen af individuelle funktionelle RNA-enheder.
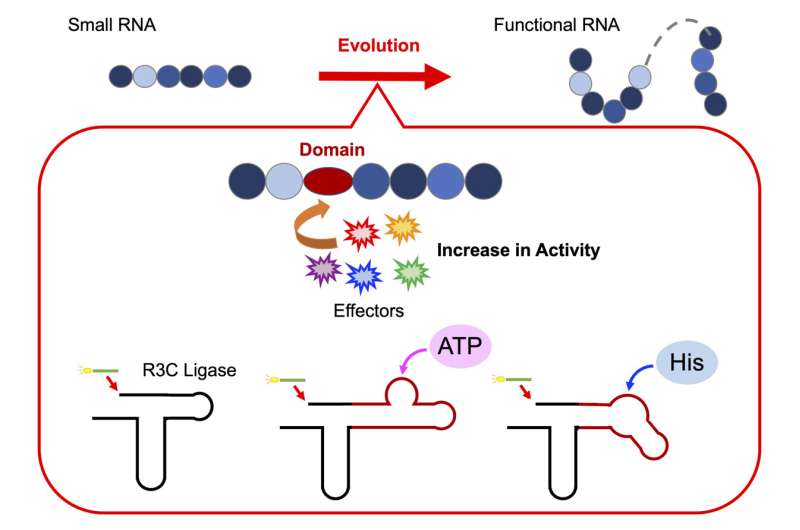
For at teste denne hypotese gennemførte professor Koji Tamura sammen med sit team af forskere ved Institut for Biologisk Videnskab og Teknologi, Tokyo University of Science, en række eksperimenter for at afkode samlingen af funktionelle ribozymer. Til dette designede de et kunstigt ribozym, R3C-ligase, for at undersøge, hvordan individuelle RNA-enheder samles for at danne en funktionel struktur.
Deres arbejde er publiceret i tidsskriftet Life .
For at give yderligere indsigt i deres forskning udtaler prof. Tamura:"R3C-ligasen er et ribozym, der katalyserer dannelsen af en 3',5'-phosphodiester-binding mellem to RNA-molekyler. Vi modificerede strukturen ved at tilføje specifikke domæner, der kan interagere med forskellige effektorer."
Inden for ribosomer, som er stedet for proteinsyntese, samles RNA-enheder for at fungere som peptidyltransferasecentre (PTC'er) på en sådan måde, at de danner et stillads til rekruttering af aminosyrer (individuelle komponenter af et peptid/protein) knyttet til tRNA'er .
Dette er et vigtigt indblik i den evolutionære historie af proteinsyntesesystemer, men det er ikke tilstrækkeligt til at spore den evolutionære vej baseret på RNA World-hypotesen.
For at undersøge, om forlængelsen af RNA, opnået ved at forbinde individuelle RNA-enheder sammen, er reguleret allosterisk, ændrede forskerne strukturen af R3C-ligasen. De gjorde dette ved at inkorporere korte RNA-sekvenser, der binder adenosintriphosphat (ATP), et vital energibærermolekyle i celler, i ribozymet. Holdet bemærkede, at R3C-ligaseaktivitet var afhængig af koncentrationen af ATP, med højere aktivitet observeret ved højere koncentrationer af ATP.
Yderligere en stigning i smeltetemperaturen (Tm værdi) viste, at bindingen af ATP til R3C-ligase stabiliserede strukturen, hvilket sandsynligvis påvirkede dens ligaseaktivitet.
Tilsvarende bemærkede de, når de fusionerede en L-histidin-bindende RNA-sekvens til ribozymet en stigning i ligaseaktivitet ved stigende koncentrationer af histidin (en nøgleaminosyre). Det er bemærkelsesværdigt, at stigningen i aktivitet var specifik for stigende koncentrationer af ATP eller histidin; ingen ændringer blev observeret som reaktion på andre nukleotidtriphosphater eller aminosyrer.
Disse resultater tyder på, at ATP og histidin fungerer som effektormolekyler, der udløser strukturelle konformationelle ændringer i ribozymet, som yderligere påvirker enzymstabilitet og aktivitet.
ATP er den centrale energibærer af cellen, som understøtter adskillige molekylære processer, mens histidin er den mest almindelige aminosyre, der findes på enzymernes aktive sted og vedligeholder deres syre-base kemi. I betragtning af ATP's og histidins vigtige roller i RNA-interaktioner og molekylære funktioner giver disse resultater ny indsigt i RNA's rolle i den tidlige evolution, herunder oprindelsen af den genetiske kode.
Desuden har manipulerede ribozymer, som den, der er udviklet i denne undersøgelse, et betydeligt løfte i et utal af applikationer, herunder målrettet lægemiddellevering, terapi, nano-biosensorer, enzymteknologi og syntese af nye enzymer med anvendelse i forskellige industrielle processer.
Samlet set kan denne undersøgelse give indsigt i, hvordan overgangen fra RNA-verdenen til den moderne "DNA/Protein-verden" fandt sted. En grundlæggende forståelse af RNA-verdenen kan til gengæld forbedre deres anvendelse i virkelige applikationer.
"Denne undersøgelse vil føre til belysningen af processen med 'allostericitetsbaseret erhvervelse af funktion og kooperativitet' i RNA-evolution. RNA-RNA-interaktionerne, RNA-aminosyre-interaktionerne og allostericiteten anvendt i denne forskning kan guide fremstillingen af vilkårlige RNA-nanostrukturer med forskellige anvendelser," konkluderer prof. Tamura.
Flere oplysninger: Yuna Akatsu et al., Udvikling af allosteriske ribozymer for ATP og l-Histidin baseret på R3C Ligase Ribozyme, Life (2024). DOI:10.3390/life14040520
Leveret af Tokyo University of Science
 Varme artikler
Varme artikler
-
 Tandsætningen af kilefisken ser ud til at være designet til at knuse skaldyr, men den spiser ogs…En skarp eftersmag:En CT-scanning af kæben på en kilefisk leverer umiskendelige beviser på hidtil ukendt fodringsadfærd. Det viser tydeligt rokkepigge indlejret i kæben på denne bruskfisk. Kredit:Maso
Tandsætningen af kilefisken ser ud til at være designet til at knuse skaldyr, men den spiser ogs…En skarp eftersmag:En CT-scanning af kæben på en kilefisk leverer umiskendelige beviser på hidtil ukendt fodringsadfærd. Det viser tydeligt rokkepigge indlejret i kæben på denne bruskfisk. Kredit:Maso -
 Fra vilde kameler til kokainflodheste, store dyr vilde verden igenDe fleste af verdens vilde heste, såsom den australske brumby, er uden for deres historiske hjemland. Kredit:Andrea Harvey Igennem historien, mennesker har taget planter og dyr med sig, da de rejs
Fra vilde kameler til kokainflodheste, store dyr vilde verden igenDe fleste af verdens vilde heste, såsom den australske brumby, er uden for deres historiske hjemland. Kredit:Andrea Harvey Igennem historien, mennesker har taget planter og dyr med sig, da de rejs -
 Hvad er biokulturel mangfoldighed, og hvorfor betyder det noget?Senegals Saloum Delta. Kredit:Bas van den Heuvel/Shutterstock Hvad har det engelske begreb om landskabet, den franske paysage, de spanske dehesas og det australske aboriginal-land til fælles? Alle
Hvad er biokulturel mangfoldighed, og hvorfor betyder det noget?Senegals Saloum Delta. Kredit:Bas van den Heuvel/Shutterstock Hvad har det engelske begreb om landskabet, den franske paysage, de spanske dehesas og det australske aboriginal-land til fælles? Alle -
 Virtuel Labrador kan hjælpe forskere med at tackle hundebidKredit:University of Liverpool En virtual reality-hund kunne en dag blive brugt som et pædagogisk værktøj til at hjælpe med at forhindre hundebid, takket være et innovativt projekt ledet af forsker
Virtuel Labrador kan hjælpe forskere med at tackle hundebidKredit:University of Liverpool En virtual reality-hund kunne en dag blive brugt som et pædagogisk værktøj til at hjælpe med at forhindre hundebid, takket være et innovativt projekt ledet af forsker
- Nanoteknologi -gennembrud kan dramatisk forbedre medicinske tests
- Sjældne 4000-årige kometer kan forårsage meteorregn på Jorden
- Sexrobotter øger potentialet for kønsbaseret vold
- Regeringen foreslår frigivelse af Fukushima-vand til havet eller luften
- Giant pulser detekteret i Pulsar PSR J1047-6709
- Alabama oversvømmet, 4 dræbt i oversvømmelser fra langsomtgående front


