Er TRP eller GLN mere sandsynligt på en proteinoverflader?
Her er hvorfor:
* Hydrofobicitet: TRP er en meget hydrofob aminosyre, hvilket betyder, at den afviser vand. Det er mere sandsynligt, at det begraves inden for kernen af et protein væk fra det vandige miljø.
* Polaritet: GLN er polær og kan danne hydrogenbindinger med vandmolekyler. Dette gør det mere kompatibelt med det hydrofile miljø i proteinoverfladen.
* størrelse: TRP er en stor aminosyre med en voluminøs sidekæde, hvilket gør den mindre velegnet til overfladeeksponering. GLN har på den anden side en mindre sidekæde, der lettere kan rumme overfladeinteraktioner.
Undtagelser:
Mens GLN generelt er mere overfladeeksponeret end TRP, er der undtagelser:
* specifikke proteinstrukturer: Nogle proteiner kan have specifikke strukturelle krav, der nødvendiggør tilstedeværelsen af TRP på overfladen.
* Funktionelle roller: TRP-rester kan undertiden være involveret i proteinfunktion og kan derfor findes på overfladen, såsom i protein-proteininteraktioner eller bindingssteder.
Kortfattet:
Den generelle tommelfingerregel er, at TRP er mere tilbøjelig til at blive begravet inden for et proteins indre, mens GLN mere sandsynligt findes på overfladen på grund af dets hydrofile natur og mindre størrelse. Der er dog undtagelser fra denne regel, afhængigt af det specifikke protein og dets funktionelle krav.
 Varme artikler
Varme artikler
-
 Hvorfor er vi voldelige?Arvede mennesker og chimpanser en voldelig natur fra en fælles forfader? Tom Brakefield/Stockbyte/Thinkstock Der er ingen tvivl om, at mennesker er voldelige væsener. Fra vold i hjemmet til krige, de
Hvorfor er vi voldelige?Arvede mennesker og chimpanser en voldelig natur fra en fælles forfader? Tom Brakefield/Stockbyte/Thinkstock Der er ingen tvivl om, at mennesker er voldelige væsener. Fra vold i hjemmet til krige, de -
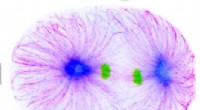 En signalvej, der begrænser dannelsen af spaltningsfure til cellens midterplanCelledeling i C. elegans -embryoet (magenta:mikrotubuli, blå:TPXL-1, grøn:kromosomer). Kredit:Ludwig Maximilian University of Munich Celledeling er en grundlæggende biologisk proces, der sikrer, a
En signalvej, der begrænser dannelsen af spaltningsfure til cellens midterplanCelledeling i C. elegans -embryoet (magenta:mikrotubuli, blå:TPXL-1, grøn:kromosomer). Kredit:Ludwig Maximilian University of Munich Celledeling er en grundlæggende biologisk proces, der sikrer, a -
 Dyrelivet betaler prisen for Kenyas ulovlige græsningafrikanske vilde hunde, elefanter, bøffel, løver, giraffer, Zebra og antilope er alle blevet ramt af skyderi, sult og sygdom, eller ved at blive tvunget ud af deres sædvanlige levesteder Det er ød
Dyrelivet betaler prisen for Kenyas ulovlige græsningafrikanske vilde hunde, elefanter, bøffel, løver, giraffer, Zebra og antilope er alle blevet ramt af skyderi, sult og sygdom, eller ved at blive tvunget ud af deres sædvanlige levesteder Det er ød -
 Kunne kondorer vende tilbage til det nordlige Californien?Reduktion af brugen af blyammunition vil gøre det muligt at genindføre kondorer i det nordlige Californien. Kredit:C. West I 2003, Det nordlige Californiens Yurok-stamme indledte bestræbelser på
Kunne kondorer vende tilbage til det nordlige Californien?Reduktion af brugen af blyammunition vil gøre det muligt at genindføre kondorer i det nordlige Californien. Kredit:C. West I 2003, Det nordlige Californiens Yurok-stamme indledte bestræbelser på
- Showtime for SpaceXs store nye raket med sportsvogn på toppen
- Nekropolis i Asyut som et vigtigt element i Egyptens kulturelle hukommelse
- Sådan fungerer akustisk levitation
- Yngste akkretionsskive fundet i stjernedannelse
- Støvundersøgelse af stjerner baner vej for exoplanetmissioner
- Robotter som redskaber og partnere i rehabilitering


