En ny vandopdelingsteknik til at generere rent brint

Billede af forskerne, med (fra venstre mod højre):Dr. Hen Dotan, Avigail Landman, Prof. Avner Rothschild, Prof. Gideon Grader. Kredit:Chen Galili, Technions talsmandsafdeling.
Elektrolytisk brintproduktion indebærer generering af brint fra vand ved hjælp af elektrisk strøm, som ideelt set skulle komme fra vedvarende strømkilder som sollys og vind. Selvom denne metode til at producere brint kunne være en meget lovende løsning til at øge bæredygtigheden, men forskerne bliver nødt til at overvinde flere centrale udfordringer, for at det kan blive udbredt.
I en nylig undersøgelse omtalt i Naturenergi , et team af forskere ved Technion-Israel Institute of Technology har adresseret nogle af disse udfordringer, præsenterer en ny teknik til spaltning af vand, der kan forbedre eksisterende elektrolytiske brintproduktionsmetoder. Deres forskning henter inspiration fra en af deres tidligere undersøgelser om fotoelektrokemisk (PEC) vandspaltning, hvor de forsøgte at kombinere solenergi og vand(foto)elektrolyse for at generere brint fra sollys og vand.
En af de største udfordringer skitseret i dette tidligere arbejde var indsamlingen af brintgas fra millioner af PEC-celler fordelt i solfeltet. I deres undersøgelse, de Technion-baserede forskere forsøgte at udvikle en teknik, der effektivt kunne tackle denne udfordring.
"Ved at tage solcelleanlæg (PV) som basisscenarie, solfarmen består af millioner af individuelle PV-celler, hvor strømmen (og spændingen) opsamles fra hver og en af dem til et metalgitter, "Avner Rothschild, en af de forskere, der har udført undersøgelsen, fortalte TechXplore. "Det er nemt med elektricitet, men ikke sådan med brintgas."
I et ideelt PEC solcelleanlæg for fremtiden, PV -celler ville blive erstattet af PEC -celler, som kan producere brint i en komponent kendt som katodekammer, og ilt i et separat kammer kaldet et anoderum. Disse to rum skal adskilles, i det mindste ved en membran, for at sikre, at brint og ilt ikke blandes, da dette ville forårsage en eksplosion. Ud over, brintgassen skal opsamles fra hver enkelt celle.
At skabe dette setup har indtil videre vist sig at være teknisk vanskeligt og dyrt, da det kræver en meget dyr rørmanifold. Ultimativt, dette har gjort realiseringen af løsninger til storstilet brintproduktion ved PEC-vandspaltning urealistisk.
"Vi søgte en vej ud af denne udfordring, og kom op med ideen om at adskille ilt- og brintrummene i PEC-cellen i to separate celler, så ilten dannes i solfeltet og frigives til atmosfæren, der henviser til, at brinten genereres i en central reaktor ved hjørnet af feltet, " sagde Rothschild. "Adskillelsen i to celler er gjort mulig ved at indsætte et andet sæt af to elektroder, kaldet hjælpeelektroder, der oplades og aflades samtidigt af OH - ioner involveret i vandspaltningsreaktionen, derved medierer ionudvekslingen mellem de to celler (hvilket er nødvendigt for at lukke det elektriske kredsløb). "
I deres tidligere papir, udgivet i Naturmaterialer , Rothschild og hans kolleger præsenterede en forstyrrende ny tilgang til vandelektrolyse (elektrolysatorer) og fotoelektrolyse (PEC) arkitekturer. Denne lovende tilgang, imidlertid, introduceret en anden udfordring med at regenerere hjælpeelektroderne, når de bliver mættede i slutningen af en produktionscyklus. Forskerne foreslog, at elektroderne kunne udskiftes i slutningen af hver cyklus, men det ville være ret besværligt, så de fortsatte med at udforske alternative løsninger.
"Vi opdagede så, at når man opvarmer hjælpeelektroden i brintcellen, efter at den blev opladet (for at blive NiOOH), det frigiver iltgasbobler spontant og regenererer til sin oprindelige tilstand (Ni (OH) 2 ), " sagde Rothschild. "Denne opdagelse førte til udviklingen af E-TAC-vandspaltningsprocessen, som er præsenteret i dette arbejde."
E-TAC, den nye vandspaltningsteknik foreslået af Rothschild og hans kolleger, har en høj energieffektivitet på 98,7 procent, derfor klarer den sig betydeligt bedre end konventionelle elektrolysatorer, som typisk har en energieffektivitet på ~70 til 80 procent for state-of-the-art enheder. En yderligere fordel ved E-TAC er, at den producerer brint og oxygen sekventielt, i de fleste andre elektrolysatorer, de produceres samtidigt. Dette fjerner i sidste ende behovet for en membran, der adskiller hydrogen og iltgasser, hvilket i høj grad forenkler konstruktionen og samlingen af cellerne, samt deres drift og vedligeholdelse.
"Potentielt, dette kan udmønte sig i store besparelser på kapital- og driftsomkostninger, fører til udviklingen af omkostningseffektiv vandspaltningsteknologi, der kan konkurrere med SMR (dampmethanreformering), tilbyder billigt brint uden CO 2 emissioner, forudsat at elektriciteten kommer fra vedvarende kilder såsom vandkraft, sol- eller vindkraft, " sagde Rothschild.
Ved konventionel vandelektrolyse, brint og oxygen produceres altid samtidigt i katode- og anoderummene, henholdsvis. Afdelingerne er placeret så tæt som muligt på hinanden, for at minimere elektriske ohmske tab, og de er adskilt af en membran for at undgå dannelsen af et eksplosivt H 2 /O 2 blanding.
"Katoden reducerer vand, generere brint (H 2 molekyler) og hydroxidioner (OH - ) gennem en reaktion kendt som HER (brintudviklingsreaktion), " sagde Rothschild. "Åh - ioner vandrer til anoden gennem elektrolytten og gennem membranen, hvor de oxideres gennem OER (oxygen evolution reaktion). Sammen, disse to reaktioner (HER og OER) fuldender vandspaltningsreaktionen:2H 2 O 2H 2 + O 2 ."
Ved konventionel vandelektrolyse, de to elektrokemiske reaktioner beskrevet af Rothschild er koblet i både tid og rum, da de opstår samtidigt, i samme celle og tæt på. I øvrigt, disse egenskaber er de samme, uanset om processen anvendes på alkaliske eller PEM -elektrolysatorer.
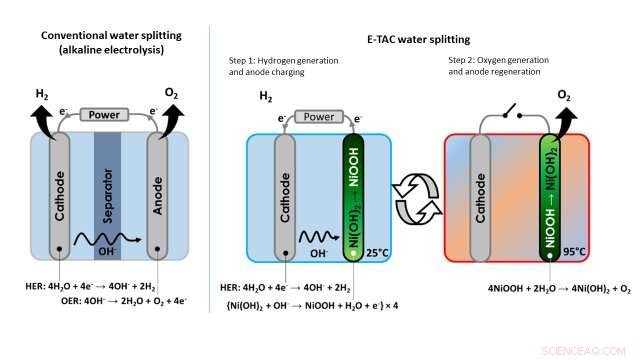
Billede, der viser forskellen mellem den konventionelle tilgang til vandspaltning (alkalisk elektrolyse) og E-TAC-vandspaltningsteknikken foreslået af forskerne. Kredit:Dotan et al.
I modsætning til denne traditionelle tilgang til vandelektrolyse, vandspaltningsprocessen, som forskerne har udtænkt, afkobler HER- og OER-reaktionerne, som i stedet opstår på forskellige tidspunkter og potentielt i forskellige dele af en enhed. I stedet for at være kontinuerlig, derfor, E-TAC kan beskrives som en 'batchproces' med to cyklusser, den første genererer hydrogen elektrokemisk og den anden oxygen via en spontan kemisk reaktion.
"Vi placerer katoden (den samme katode, der bruges i alkalisk elektrolyse) og anoden (som er forskellig fra anoden i konventionel elektrolyse) i en elektrolysecelle og sender strøm mellem dem, " sagde Rothschild. "Katoden genererer brint gennem HER-reaktionen, ligesom det gør i det konventionelle vandelektrolysetilfælde, men anoden gør en helt anden ting. Anoden bliver i det væsentlige opladet ved at absorbere OH - ioner, der dannes ved katoden, og omdannes gradvist fra Ni(OH) 2 (nikkelhydroxid) til NiOOH (nikkeloxyhydroxid)."
Interessant nok, reaktionen, der produceres i anoden, er den samme, som sker ved katoden på alkaliske batterier (f.eks. Ni-MH-batterier), mens de oplades. Dette tyder på, at det kan fungere godt i mange cyklusser, ligesom det gør i alkaliske batterier.
Sommetider, imidlertid, opladningen af anoden i E-TAC-processen skal afbrydes, fordi hvis den bliver overopladet, det kunne begynde at generere ilt. Når ladningen går over et vist niveau, derfor, forskerne er nødt til at begrænse den spænding, der påføres cellerne for at undgå mulige eksplosioner, der stammer fra samgenerering af ilt og brint.
"For at fortsætte E-TAC-processen, vi skal derefter regenerere den ladede anode (NiOOH) tilbage til dens oprindelige tilstand (Ni (OH) 2 ), " Rothschild explained. "We do so by raising its temperature, thereby accelerating the rate of the spontaneous chemical reaction between the charged anode and water, which releases oxygen and regenerates the anode back to its initial state."
The technique devised by Rothschild and his colleagues thus entails the use of heat to control the chemical reaction that generates oxygen, as the rate of the reaction slows down at low temperatures and accelerates at high temperatures. The generation of hydrogen occurs at a low or ambient temperature, and the generation of oxygen at high temperatures around 95 degrees Celsius. This is why the researchers decided to call it the E-TAC process, which stands for electrochemical-thermally activated chemical process.
"In the proof-of-concept lab tests presented in our article, we manually moved the anode from the cold cell (i.e. a glass beaker filled with alkaline aqueous solution at ambient temperature) to the hot cell (i.e. the same type of beaker, but heated to 95 degrees Celsius), so the separation between hydrogen and oxygen generation was not only in time but also in place, " Rothschild explained. "However, in a real-world industrial system, we foresee a different scenario in which the two electrodes (anode and cathode) and stationary (not moving), whereas the cell in which they are is filled sequentially with cold or hot electrolyte solutions."
Separating the production of hydrogen and oxygen, which removes the need for a membrane separating the two different chambers inside electrolytic cells, results in substantial savings over traditional electrolysis approaches. Faktisk, sealing the membrane is generally expensive and also complicates the overall production process. The membrane in conventional systems requires high-purity water and ongoing maintenance, all of which are unnecessary in E-TAC.
Ud over, the technique devised by Rothschild and his colleagues entirely eliminates the risk of volatile encounters between oxygen and hydrogen, as well as resulting explosions. In traditional systems, på den anden side, this risk is still present, as the membrane could rip or its seal could break.
"I øjeblikket, the use of membranes also limits the pressure in hydrogen production, " Rothschild said. "E-TAC renders the membrane unnecessary, thus facilitating hydrogen production under much higher pressure and eliminating some of the high costs of compressing the hydrogen later. I øvrigt, in the new process we proposed, oxygen is produced via a spontaneous chemical reaction between the charged anode and the water, without using an electrical current. This reaction eliminates the need for electricity during oxygen production and increases energetic efficiency from ~70 to 80 percent using customary methods to an unprecedented 98.7 percent."
The technique developed by Rothschild and his colleagues could lower operating costs of sustainable hydrogen production and equipment costs. The researchers have estimated that the production costs for equipment based on E-TAC would be approximately half of those for existing technologies.
"The process we invented presents a conceptual breakthrough in water splitting, and in view of the advantages it offers, it may become a game-changer and lead to a new technology for hydrogen production from water without CO 2 emissions, which could compete with SMR to produce clean hydrogen and enable the transition from fossil fuels to clean hydrogen fuel, " Rothschild said.
After they finished writing their paper, the researchers at Technion patented their invention and founded a start-up called H 2 Pro, with the mission of developing and distributing new water splitting technology based on the E-TAC technique. They hope to soon commercialize this technology by scaling-up the electrodes and cells used in their study, constructing and testing hydrogen generators based on the E-TAC water-splitting process, optimizing their operation scheme and examining high-pressure hydrogen production.
"We also plan to carry out further academic research to study new electrode materials and apply advanced analytical methods to understand the correlations between electrode composition and microstructure and its function properties, in order to develop the next generation of Ni(OH) 2 -based electrodes for our E-TAC water-splitting process, " Rothschild said. "Our goal is to improve their capacity (so that we can run longer processes) with fast charging and regeneration rates to enable high hydrogen production rates."
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Tesla anlægger sag mod Ontarios regeringI denne 8. juli, 2018, fil foto, 2018 Model 3 sedans står udstillet uden for et Tesla showroom i Littleton, Colo. Torsdag d. 9. august, Tesla-aktier er faldet tilbage til tæt på det niveau, de handled
Tesla anlægger sag mod Ontarios regeringI denne 8. juli, 2018, fil foto, 2018 Model 3 sedans står udstillet uden for et Tesla showroom i Littleton, Colo. Torsdag d. 9. august, Tesla-aktier er faldet tilbage til tæt på det niveau, de handled -
 Nike udråber skarpe annoncer, men aktierne falder på blandet indtjeningNike rapporterede kvartalsvise omsætningsstigninger i september 2018 i alle fire af sine regioner, med den stærkeste stigning i Kina, hvor omsætningen år-til-år steg 24 procent til 1,4 milliarder doll
Nike udråber skarpe annoncer, men aktierne falder på blandet indtjeningNike rapporterede kvartalsvise omsætningsstigninger i september 2018 i alle fire af sine regioner, med den stærkeste stigning i Kina, hvor omsætningen år-til-år steg 24 procent til 1,4 milliarder doll -
 Australiens største bank mister 20 millioner kunderekorderAustraliens urolige Commonwealth Bank indrømmede torsdag, at det havde mistet finansielle rekorder for næsten 20 millioner kunder i en større sikkerhedsfejl Australiens urolige Commonwealth Bank i
Australiens største bank mister 20 millioner kunderekorderAustraliens urolige Commonwealth Bank indrømmede torsdag, at det havde mistet finansielle rekorder for næsten 20 millioner kunder i en større sikkerhedsfejl Australiens urolige Commonwealth Bank i -
 3D-trykte kanoner kan være farligere for deres brugere end målLille bitte, men dødbringende, mangler kan gemme sig i dele af denne 3D-trykte pistol. Justin Pickard/Flickr, CC BY-SA På trods af frygt for, at kanoner fremstillet med 3D-printere let vil lade kr
3D-trykte kanoner kan være farligere for deres brugere end målLille bitte, men dødbringende, mangler kan gemme sig i dele af denne 3D-trykte pistol. Justin Pickard/Flickr, CC BY-SA På trods af frygt for, at kanoner fremstillet med 3D-printere let vil lade kr
- Hvor meget vil vores emissioner have indflydelse på det fremtidige istab i Antarktis?
- Afrikanske handelsruter skitseret af middelalderperler
- Ridessharing links kan øge transitbrugen i forstæderne
- GPM-satellit sonderer Tropical Cyclone Iris svækkelse nær den australske kyst
- Mendels-eksperimenter: Undersøgelsen af ærteplanter og arv
- Ny teknik skaber forudsigeligt kompleks, bølgede former


