Afslører, hvordan et batterimateriale fungerer
1. Introduktion:Kraften bag batterier
Batterier er udbredt i vores daglige liv og driver alt fra smartphones og bærbare computere til elektriske køretøjer og industrimaskiner i stor skala. I hjertet af disse batterier ligger batterimaterialer, de nøglekomponenter, der er ansvarlige for at lagre og frigive energi gennem elektrokemiske reaktioner. At forstå, hvordan disse materialer fungerer, giver et indblik i den fascinerende videnskab bag energilagring og omdannelse.
2. Grundlæggende koncepter:Elektroder og elektrolytter
Et batteri består af to elektroder (anode og katode) nedsænket i en elektrolyt. Når de er forbundet til et eksternt kredsløb, forekommer elektrokemiske reaktioner ved disse elektroder, hvilket muliggør strømmen af elektroner og generering af elektricitet.
3. Anode- og katodematerialer
Anoden er den negative elektrode, hvor oxidation (tab af elektroner) finder sted. Anodematerialer omfatter almindeligvis grafit (i lithium-ion-batterier) og zink (i zink-luft-batterier). Katoden er på den anden side den positive elektrode, hvor der sker reduktion (forstærkning af elektroner). Katodematerialer kan være metaloxider (f.eks. lithium-koboltoxid i lithium-ion-batterier) eller svovl (i lithium-svovl-batterier).
4. Elektrolytter:Letter ionbevægelse
Elektrolytten er en kritisk komponent, der tillader bevægelse af ioner mellem anoden og katoden under elektrokemiske reaktioner. Elektrolytter kan være flydende (f.eks. lithiumsalte opløst i organiske opløsningsmidler i lithium-ion-batterier), faste (f.eks. polymerelektrolytter i faststofbatterier) eller endda gelbaserede.
5. Elektrokemiske reaktioner:strømmen af elektroner
Under afladning sker der oxidation ved anoden, hvorved elektroner frigives, der bevæger sig gennem det eksterne kredsløb til katoden. Samtidig sker der reduktion ved katoden, der forbruger elektronerne og kombineres med positivt ladede ioner fra elektrolytten. Denne strøm af elektroner genererer elektricitet.
6. Genopladning:Reversering af processen
Ved genopladning påføres en ekstern strømkilde, som vender de elektrokemiske reaktioner. Elektroner strømmer tilbage til anoden og reducerer den, mens katoden undergår oxidation. Elektrolytten letter bevægelsen af ioner for at opretholde ladningsbalancen.
7. Interkalations- og konverteringsmekanismer
Batterimaterialer kan gennemgå forskellige reaktionsmekanismer under elektrokemiske processer. Interkalation involverer indsættelse eller fjernelse af ioner i eller fra elektrodens krystalstruktur, mens konvertering involverer dannelsen af nye kemiske forbindelser. Disse mekanismer bestemmer batteriets specifikke energitæthed og ydeevne.
8. Udfordringer og fremskridt
Jagten på forbedret batteriteknologi drejer sig om at løse udfordringer som energitæthed, levetid, sikkerhed og omkostninger. Forskning fokuserer på at optimere materialesammensætninger, nanostrukturerede materialer og nye elektrolytter for at forbedre batteriets ydeevne.
Konklusion
Ved at optrevle batterimaterialernes forviklinger får vi en dybere forståelse for den videnskab, der ligger til grund for vores daglige energikilder. Gennem løbende forskning og innovation lover udviklingen af effektive og bæredygtige batterimaterialer at revolutionere industrier, fremme anvendelsen af ren energi og fortsætte med at drive teknologiske fremskridt.
Sidste artikelHvad er teknisk alkohol?
Næste artikelKemikere opdager, hvordan blåt lys fremskynder blindhed
 Varme artikler
Varme artikler
-
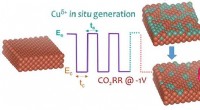 Samtidig tuning af overfladestruktur og oxidationstilstand af kobberkatalysatorerKredit:Arán-Ais et al. Elektrisk energi afledt af vedvarende kilder kunne bruges til at omarrangere bindinger i kuldioxid (CO 2 ) og vandmolekyler til komplekse kulbrinter, som derefter kan bræn
Samtidig tuning af overfladestruktur og oxidationstilstand af kobberkatalysatorerKredit:Arán-Ais et al. Elektrisk energi afledt af vedvarende kilder kunne bruges til at omarrangere bindinger i kuldioxid (CO 2 ) og vandmolekyler til komplekse kulbrinter, som derefter kan bræn -
 LED taburet til at bekæmpe rygsmerterLED taburetten tilskynder til sund siddestilling. På MS Wissenschaft, besøgende kan endda bruge det til at spille bevægelsesspil. Kredit:Fraunhofer IAO At sidde ned i timevis er farligt for vores
LED taburet til at bekæmpe rygsmerterLED taburetten tilskynder til sund siddestilling. På MS Wissenschaft, besøgende kan endda bruge det til at spille bevægelsesspil. Kredit:Fraunhofer IAO At sidde ned i timevis er farligt for vores -
 London-firmaet fornyer løn ved at lade personalet fastsætte lønVæddemålsfirmaet Smarkets har vedtaget en radikal løngennemsigtighedspolitik, som omfatter kolleger, der skriver under på hinandens lønstigninger På en baggrund i Storbritannien af kønsbestemte
London-firmaet fornyer løn ved at lade personalet fastsætte lønVæddemålsfirmaet Smarkets har vedtaget en radikal løngennemsigtighedspolitik, som omfatter kolleger, der skriver under på hinandens lønstigninger På en baggrund i Storbritannien af kønsbestemte -
 Det er klart for Tesla at købe Berlin fabrikspladsTeslas Berlin-forbindelse Tyske regionale lovgivere gav torsdag grønt lys for elbilproducenten Tesla til at købe jord lige uden for Berlin til sin første europæiske fabrik. Gigafactory investerin
Det er klart for Tesla at købe Berlin fabrikspladsTeslas Berlin-forbindelse Tyske regionale lovgivere gav torsdag grønt lys for elbilproducenten Tesla til at købe jord lige uden for Berlin til sin første europæiske fabrik. Gigafactory investerin
- Hvordan er matematik brugt i madlavning?
- Australske arkæologer droppede udtrykket stenalder for årtier siden, og det skal du også
- Forskere afslører direkte beviser på, hvordan HIV invaderer sunde celler
- Forskere udvikler renere, grønnere gødning
- Blackout efter tyfon rejser katastrofeforberedende spørgsmål i Japan
- Gamle afføring hjælper med at vise, at klimaændringer bidrog til Cahokias fald


