Selvsamlende cykliske proteinhomo-oligomerer
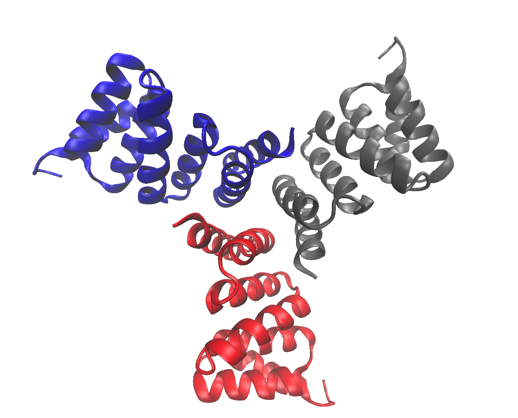
Den højopløselige krystalstruktur af et af de undersøgte proteiner, en beregningsmæssigt designet trimer. Strukturen er deponeret i proteindatabanken med adgangsnummer 5HRZ. Kredit:Lawrence Berkeley National Laboratory
Cykliske proteiner, der samles fra flere identiske underenheder (homo-oligomerer), spiller nøgleroller i mange biologiske processer, herunder cellesignalering og enzymatisk katalyse og proteinfunktion. Forskere i Berkeley Lab's Molecular Biophysics and Integrated Bioimaging (MBIB) afdeling arbejdede med University of Washingtons David Baker, som førte et team til at designe i silico og krystallisere selvsamlende cykliske homo-oligomerproteiner.
Ved at forudsige og designe disse højere ordens oligomerer, Baker og hans team har opnået en forståelse af de grundlæggende principper bag oligomer-oligomer interaktioner. Ud over de interne interaktioner af selve proteinet, disse designede oligomerer kan bruges til at udforske grundlæggende spørgsmål om, hvordan strukturen af signalmolekyler påvirker receptorernes adfærd og cellulær respons.
En strategi blev udviklet til at designe grænseflader på idealiserede proteiner, der sigter mod at dirigere deres samling i multimere komplekser. Berkeley Lab-forskere brugte strukturel karakterisering - både røntgenkrystallografi og røntgenstrålespredning med lille vinkel (SAXS) - for at vise, at mange af designerne overtog måloligomeriseringstilstanden og den forudsagte struktur. Ikke alene viser deres arbejde, at videnskabsmænd har en grundlæggende forståelse af, hvad der bestemmer oligomerisering, det viser også, at de kan designe proteiner med afstembar form, størrelse, og symmetri til en række biologiske anvendelser.
Noget af det røntgenkrystallografiske arbejde, der er inkluderet i papiret, blev udført i regi af Crystallography Collective-programmet, som drives af forsker Banumathi Sankaran ved Advanced Light Source. Medforsker Henrique Pereira krystalliserede proteinerne designet af forskere fra University of Washington. Sankaran og Peter Zwart, MBIB stabsforsker, indsamlede krystallografiske data på Beamline 5.0.2 i Berkeley Center for Structural Biology og løste strukturerne. For at få information om den designede proteindynamik, Kathryn Burnett og Greg Hura fra MBIB udførte SAXS på SIBYLS beamline.
Pereira, Sankaran, og Zwart har været medforfattere på adskillige papirer med Baker og hans team, som alle følger et tema om proteindesign og strukturvalidering.
"Cykliske homo-oligomerer spiller vigtige roller i biologisk funktion, " sagde Sankaran. "Her har vi et andet syntetisk design, der har vist sig at matche det beregningsmæssige design med både undersøgelser af små vinkelløsninger og røntgenspredning."
Dette arbejde, sammen med de buede beta-ark og trimeriske metalloprotein-designs, udvide mulighederne for at udvikle nye terapeutiske midler og biomaterialer.
 Varme artikler
Varme artikler
-
 Nye aktive ingredienser fra værktøjskassenSkematisk diagram af værktøjskassesystemet af NRPS-enzymer til produktion af nye aktive ingredienser. Fragmenter fra naturlige systemer (grøn, magenta, blå) samles igen i en ny rækkefølge (midten) og
Nye aktive ingredienser fra værktøjskassenSkematisk diagram af værktøjskassesystemet af NRPS-enzymer til produktion af nye aktive ingredienser. Fragmenter fra naturlige systemer (grøn, magenta, blå) samles igen i en ny rækkefølge (midten) og -
 Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne
Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne -
 DNA med et twist:Opdagelsen kan fremme udviklingen af antibiotikaDNA-replikation kan forhindres af supercoils. Kredit:University of York Forskere afslører, hvordan en molekylær maskine i bakterieceller forhindrer dødelig DNA-vridning, som kan være afgørende i u
DNA med et twist:Opdagelsen kan fremme udviklingen af antibiotikaDNA-replikation kan forhindres af supercoils. Kredit:University of York Forskere afslører, hvordan en molekylær maskine i bakterieceller forhindrer dødelig DNA-vridning, som kan være afgørende i u -
 Hvad er en kovalent obligation?Er du god til at dele med andre? Så er du muligvis kovalent, som i atombindinger. Der er to typer atombindinger, der kan danne et molekyle eller en forbindelse, der binder dem sammen. En kovalent bind
Hvad er en kovalent obligation?Er du god til at dele med andre? Så er du muligvis kovalent, som i atombindinger. Der er to typer atombindinger, der kan danne et molekyle eller en forbindelse, der binder dem sammen. En kovalent bind
- Stillehavsø -lande kan miste 50 - 80% af fiskene i lokale farvande under klimaændringer
- Fornyelse af videnskaben:Giver plads til flere stemmer
- Virtual reality bidrager til turismen gennem berøring, lugt og virkelige folks oplevelser
- Italiensk renæssance:Troen på berøring som frelse var stærkere end frygt for smitte
- Store bølge-vektor fonontilstande i silicium nanomembraner
- Unge mennesker, der ofte skændes med deres forældre, er bedre borgere, forskningsfund


