Forskere afslører dobbelt levetid for solsikkeenzym

Kredit:University of Western Australia
Forskere har forklaret, hvordan et proteinskærende enzym kan forbinde enderne af proteiner sammen, skabe protein cirkler; et fund med umiddelbare anvendelser til at producere terapeutiske lægemiddelbehandlinger, der er offentliggjort i en undersøgelse i open access-tidsskriftet eLife .
Det fælles enzym i midten af undersøgelsen er fra den almindelige solsikke og lever et dobbelt liv - i stand til at skære proteiner, men også slå dem sammen. Tidligere har processen fra skæring til sammenføjning blev ikke forstået.
Forskere fra University of Western Australia og University of Minnesota har endelig givet en strukturel forklaring på, hvordan solsikker laver superstabile proteinringe og ved slutninger, hvordan de mange andre planter med cirkulære proteiner også gør det.
Holdet og andre rundt om i verden havde tidligere vist, at enzymet kunne skære proteiner, og også at nogle få kunne slutte sig til dem nogle gange.
Ved at lave en proteinkrystal af enzymet, det UWA-ledede hold var i stand til at se på proteinets form i tre dimensioner og så også en lille smule protein fanget i enzymets 'kæber' - det, der kaldes et tetraedrisk mellemprodukt. Denne information, kombineret med forsøg med at introducere mutationer i proteinet, forklaret, hvordan enzymet tager en proteinstreng og skaber en proteinring med den.
Arbejdet er af interesse for kemikere og bioteknologer, især på grund af den nuværende interesse i cirkulariseringsprocessen for dets anvendelse til at generere et væld af cirkulære proteinstilladser, der kan bruges som terapeutiske lægemiddelbehandlinger.
Undersøgelsen viser krystalstrukturen af en aktiv form af enzymet kendt som AEP (asparaginyl endo-peptidase) fra solsikkefrø. Forfatterne adresserede direkte spørgsmålet om, hvordan AEP'er faktisk producerede cirkulære proteiner.
Hovedforfatter Dr. Joel Haywood, en forskningsmedarbejder ved UWA's School of Molecular Sciences sagde, at AEP-enzymer blev fundet i alle planter, og at deres bedst kendte opgave var at forsvare planter mod patogener og at modne frøopbevaringsproteiner, men man troede, at nogle havde specialiseret sig til at producere cirkulære proteiner, der var superstabile og stive.
"De fleste videnskabsmænd tror, at disse proteinringe beskytter planter mod skadedyr, " sagde Dr. Haywood.
"Vi var heldige at bemærke et tetraedrisk mellemliggende i strukturen. De er meget sjældne, men ekstremt hjælpsom, da det er som at fange enzymet ved at skære og forbinde. "
UWA laboratoriechef Dr. Joshua Mylne sagde, at det, der overraskede forskerne, var, at enhver AEP tilsyneladende kunne cirkulere proteiner, forudsat at enzymet var 'aktiveret' korrekt og fik det rigtige protein og betingelser til at cirkulere.
"Vi viste dette ved hjælp af et par AEP'er fra planter, der helt mangler cirkulære proteiner, "Dr. Mylne sagde.
"Nu har vi fundet ud af, hvordan man krystalliserer disse enzymer, og hvordan de virker, vi ser på, hvordan man bruger bakterier til billigt at skabe højeffektive enzymer."
Dr. Mylne ledede holdet af australske og amerikanske videnskabsmænd, der afslørede enzymprocessen gennem det australske forskningsråd-støttede studie "Strukturel basis for ribosomal peptidmakrocyklisering i planter."
Sidste artikelBakterier producerer guld ved at fordøje giftige metaller
Næste artikelMåling af molekylære interaktioner
 Varme artikler
Varme artikler
-
 En bærbar måleenhed til at registrere optimal modenhed i tomaterJosu Trebolazabala analyserer sammensætningen af en tomat ved hjælp af et Raman-spektrometer. Kredit:Txetxu Berruezo Et bærbart Raman-spektrometer, en enhed, der bruges inden for meget forskelli
En bærbar måleenhed til at registrere optimal modenhed i tomaterJosu Trebolazabala analyserer sammensætningen af en tomat ved hjælp af et Raman-spektrometer. Kredit:Txetxu Berruezo Et bærbart Raman-spektrometer, en enhed, der bruges inden for meget forskelli -
 Små geler opsuger intestinale toksinerMikrogeler er vist ovenfor med sukkermotiver efter binding fluorescensmærkede lektiner. Kredit:Alexander Kuehne Bakterielle infektioner, der er målrettet mod tarmen, kan forårsage tilstande, der s
Små geler opsuger intestinale toksinerMikrogeler er vist ovenfor med sukkermotiver efter binding fluorescensmærkede lektiner. Kredit:Alexander Kuehne Bakterielle infektioner, der er målrettet mod tarmen, kan forårsage tilstande, der s -
 Tværfaglige interaktioner inspirerer til nye opdagelserTakayuki Kojima med det katalytiske målesystem. Kredit:Tohoku University Efter en tværfaglig tilgang, forskere i Japan har fundet nye katalysatorer ved hjælp af unikke Heusler-legeringer. De flest
Tværfaglige interaktioner inspirerer til nye opdagelserTakayuki Kojima med det katalytiske målesystem. Kredit:Tohoku University Efter en tværfaglig tilgang, forskere i Japan har fundet nye katalysatorer ved hjælp af unikke Heusler-legeringer. De flest -
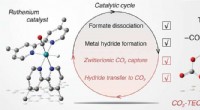 Overvågning af mellemprodukter i CO2 -omdannelse til formiat ved hjælp af metalkatalysatorTriethanolamin (TEOA) er aktivt engageret i centrale reaktionstrin i den fotokatalytiske cyklus til omdannelse af kuldioxid (CO2) af rutheniumcarbonylkomplekser. Kredit: Journal of the American Chemic
Overvågning af mellemprodukter i CO2 -omdannelse til formiat ved hjælp af metalkatalysatorTriethanolamin (TEOA) er aktivt engageret i centrale reaktionstrin i den fotokatalytiske cyklus til omdannelse af kuldioxid (CO2) af rutheniumcarbonylkomplekser. Kredit: Journal of the American Chemic
- Den hollandske regering præsenterer foranstaltninger til at reducere CO2 -udledningen
- Bøller, tyve og høvdinge:De skjulte omkostninger ved psykopater på arbejde
- Fire anholdelser efter Taiwans første bitcoin-røveri
- NASA finder delfin, der svømmer mod vindskydning
- To chirale katalysatorer arbejder hånd i hånd
- Sådan fungerer elektroforese


