Forskere tager billeder af antistoffer, der arbejder sammen mod malaria
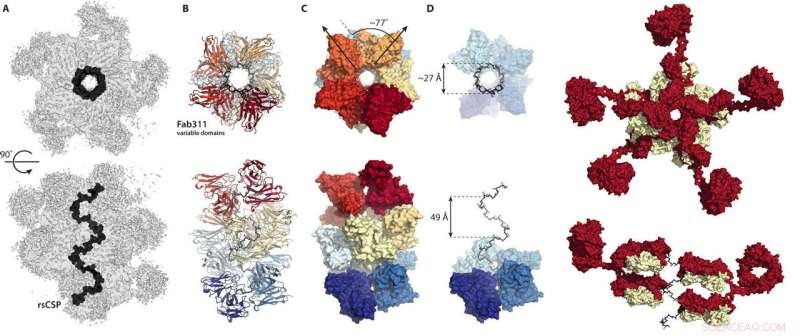
Disse tal fra den nye Videnskabens fremskridt papir viser, hvordan antistoffer binder sammen for at låse malarias circumsporozoit-protein i en spiralkonformation. Kredit:Wilson/Ward labs, Scripps Research
Forskere, der undersøger, hvordan det menneskelige immunsystem forsvarer sig mod malaria, har afsløret et sjældent fænomen:antistoffer, der arbejder sammen om at binde sig til et sårbart sted på parasitten.
Den nye forskning, udgivet for nylig i Videnskabens fremskridt , viser, at antistoffer, der arbejder sammen, kan resultere i, at et protein på parasittens celleoverflade låser den fast i en spiralform, som en bred proptrækker, blokere parasitten i at starte sin livscyklus i den menneskelige vært og, derfor, beskytte mod infektion.
"De første billeder var ganske bemærkelsesværdige og gav os vores første indsigt i, hvordan det forlængede overfladepeptid kunne genkendes, " siger Andrew Ward, Ph.D., en Scripps Research professor og tilsvarende forfatter til undersøgelsen. "CryoEM var unikt egnet til at løse denne struktur og åbner døren for at løse andre som den. For at hjælpe med at lave en effektiv vaccine, vi er nødt til at forstå den rigtige måde at genkende dette typisk fleksible peptid af antistoffer."
Studiet er en del af en international indsats for at forbedre den mest avancerede malariavaccine, kaldet RTS, S, der har været i kliniske forsøg. Kandidatvaccinen er i øjeblikket cirka 25 til 50 procent effektiv afhængigt af vaccinekuren, men med hundredtusindvis af mennesker, der stadig dør af malaria hvert år, forskere leder efter måder at redesigne eller omformulere vacciner på.
At gøre dette, videnskabsmænd på Scripps Researchs campus i Californien undersøger de antistoffer, som den menneskelige krop producerer, når de får RTS, S-vaccine. De er især interesserede i antistoffer, der binder til malariaparasitten tidligt i dens livscyklus og beskytter mod infektion – og om disse antistoffer efterligner dem, der produceres af naturlig infektion.
"Hvis du kan blokere den første fase hos mennesker, du kan blokere hele parasittens livscyklus, " siger Jonathan Torres, forskningsassistent ved Scripps Research og medforfatter af undersøgelsen.
Disse beskyttende antistoffer er kendt for at binde til malarias circumsporozoitprotein, det mest rigelige protein på overfladen af parasitten, men ingen har været i stand til at få et klart overblik over, hvordan de gør det. At forstå, hvordan disse antistoffer gør deres job, kan hjælpe med at guide designet af malariavacciner, der kan udløse det samme antistofrespons. Denne teknik kaldes rationelt vaccinedesign.
Ved hjælp af en billedbehandlingsteknik kaldet kryo-elektronmikroskopi (EM), forskerne fik de første billeder af et antistof bundet til circumsporozoit -proteinet. Undersøg den første forfatter David Oyen, Ph.D., en forskningsmedarbejder hos Scripps Research, siger, at han var overrasket over, hvad cryo-EM-strukturerne afslørede.
Proteinets form har altid været svær at forestille sig på grund af et stort lavkompleksitetsområde i midten af proteinet bestående af mange fire aminosyregentagelser, der giver proteinet en floppy, fleksibel form. Oyen troede, at antistoffer ville binde sig til dette område "som perler på en snor."
I stedet, kryo-EM-strukturerne viste gentagelsesregionen af circumsporozoit-proteinet låst i en spiralstruktur, med 11 antistoffragmenter (Fab311), der stikker ud fra deres bindingssteder, som består af to gentagelser, og stråler tangentielt fra den langstrakte spiral.
Endnu mere overraskende, spiralstabiliteten bibringes af kontakterne mellem antistofferne. "Det er som om de kæder arme sammen for at danne et stærkere kompleks, " siger Oyen. Så vidt forskerne er klar over, dette er første gang den tredimensionelle struktur af gentagelsesregionen af circumsporozoite-proteinet er blevet belyst, takket være de stabiliserende inter-antistof-kontakter. "Det er kun på grund af gentagelsen af flere sekvenser på dette protein, at disse inter-antistof kontakter er mulige, " siger Oyen.
"Denne struktur er meget spændende-den gentagne sekvens af fire aminosyrer i sig selv var blevet eksperimentelt fundet for mange år siden til at danne en beta-drejning og de flere gentagelser forudsagt for spiralformede strukturer, men denne struktur er meget forskellig fra dem, da det er en meget bred og meget langstrakt proptrækker som en stor vindeltrappe, " siger Ian Wilson, DPhil, Hansen professor i strukturel biologi ved Scripps Research, formand for Institut for Integrativ Strukturel og Beregningsbiologi og medkorresponderende forfatter til undersøgelsen.
Antistoffet vist med circumsporozoite-proteinet i denne undersøgelse er blot et af mange, som holdet planlægger at afbilde med cryo-EM. De håber at sammenligne strukturer for at se, om beskyttende antistoffer deler nogen egenskaber. Nogle kan have inter-antistof kontakter, nogle måske ikke.
"Vi ønsker at gøre malariavaccinen så god som muligt, "Oyen siger. "Og vi håber, vi kan bruge disse kryo-EM strukturer til at designe nye eller forbedrede vaccinekandidater."
Sidste artikelHonning, Jeg krympede cellekulturen
Næste artikelDen japanske nobelpristager for kemi Shimomura dør, 90 år gammel
 Varme artikler
Varme artikler
-
 Forskere designer polymer, der kan dræbe lægemiddelresistente bakterierCo-beta-peptidbehandlingen viser sig at udrydde biofilmbakterier som MRSA, en særlig vanskelig form for bakterier at behandle Kredit:Singapore-MIT Alliance for Research and Technology (SMART) Fors
Forskere designer polymer, der kan dræbe lægemiddelresistente bakterierCo-beta-peptidbehandlingen viser sig at udrydde biofilmbakterier som MRSA, en særlig vanskelig form for bakterier at behandle Kredit:Singapore-MIT Alliance for Research and Technology (SMART) Fors -
 Epitaksiale antiperovskit/perovskite heterostrukturer til materialedesignSkematisk repræsentation af krystalstrukturerne af M3XN nitrid antiperovskite og ABO3 oxid perovskite forbindelser og deres grænseflader. (A) M3XN og ABO3 ideelle enhedsceller, der viser deres geometr
Epitaksiale antiperovskit/perovskite heterostrukturer til materialedesignSkematisk repræsentation af krystalstrukturerne af M3XN nitrid antiperovskite og ABO3 oxid perovskite forbindelser og deres grænseflader. (A) M3XN og ABO3 ideelle enhedsceller, der viser deres geometr -
 Sådan neutraliseres Muriatic AcidMuriatic acid er et almindeligt navn for saltsyre, et stærkt ætsende kemisk stof. Denne forbindelse har adskillige industrielle og indenlandske anvendelser, lige fra mad, metaller og polymerforarbejdn
Sådan neutraliseres Muriatic AcidMuriatic acid er et almindeligt navn for saltsyre, et stærkt ætsende kemisk stof. Denne forbindelse har adskillige industrielle og indenlandske anvendelser, lige fra mad, metaller og polymerforarbejdn -
 EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d
EN SKY af muligheder:At finde nye terapier ved at kombinere lægemidlerSkematisk repræsentation af filtrerings- og klyngeproceduren, der fører til 308 CLOUD-lægemidlerne. Kredit:(c) Naturens kemiske biologi / Stefan Kubicek CeMM Library of Unique Drugs (CLOUD) er d
- Underligt jordskælv afslører skjult mekanisme
- Undersøgelse:Det er ødelæggende almindeligt, at afrikanske mødre oplever at miste børn
- Kognitiv undersøgelse viser, at mangel på tosproget uddannelse påvirker engelsksprogede skrivefæ…
- Nyligt opdagede planeter, der ikke er så sikre mod stjerneudbrud som først antaget
- Hvordan blev de trojanske asteroider opdaget og navngivet?
- Sådan beregnes koefficienten for molarabsorption


