Kemisk reb-trick på molekylært niveau:Mekanismeforskning hjælper, når trial and error fejler
I de fleste industrielle kemiske reaktioner kombineres katalysatorer med udgangsmaterialerne og ledsager dem gennem mellemstadier til produktet. I kemi er denne vej kendt som reaktionsmekanismen, og den er en slags sort boks:ingen ved, hvad der sker på molekylært niveau i starten.
Hvis reaktionsresultatet i laboratoriet ikke lever op til forventningerne, tyr kemikerne først til forsøg og fejl. Kort sagt ændrer de reaktionen, indtil den virker. Nogle gange er det dog værd at se nærmere på reaktionsmekanismen, som Dr. Nora Jannsen ved Leibniz Institute for Catalysis i Rostock viser ved hjælp af en modelreaktion.
Hun offentliggjorde for nylig sine resultater, som hun opnåede som en del af sin doktorgrad, i Journal of the American Chemical Society .
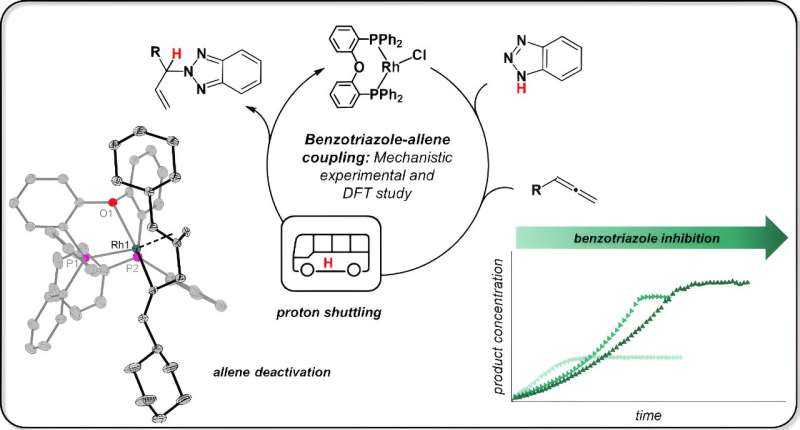
Modelreaktionen lyder uspektakulær og frem for alt mærkelig i lægmandens øre, forklarer Jannsen. "Benzotriazol, normalt en korrosionshæmmer, omdannes til et nyt stof med en allen (vægten her er på anden stavelse) ved hjælp af en rhodiumkatalysator." Dette kaldes så allylbenzotriazol og kan bruges i en række forskellige synteser. Reaktionen er udviklet af en forskergruppe ledet af prof. Breit ved universitetet i Freiburg.
Funktionsgruppe indstillet præcist
Det lykkedes kollegerne i Freiburg netop at knytte en "funktionel gruppe" til en meget specifik position inden for benzotrialzol. Det er her en nitrogen-brintbinding (N–H) er placeret, som Jannsen forklarer.
"Funktionelle grupper" er vigtige som molekylære segmenter, fordi de er ansvarlige for den specifikke, f.eks. farmaceutiske, effekt.
"Freiburg-teamet ønskede at placere sådan en gruppe i benzotriazol præcis hvor N-H-bindingen er, og N-H-bindingen må vige for dette," fortsætter Jannsen. Det lykkedes kollegerne. "Men de forstod ikke, på hvilket grundlag de havde opnået dette."
Det er uheldigt. For kun med en forståelse af de molekylære hændelser kan reaktionen specifikt anvendes og optimeres i fremtiden. Det var formålet med Jannsens afhandling, som hun med succes forsvarede i Rostock i 2023.
Idé:Katalysator bryder båndet
Så hvordan virker sådan en reaktion? Start og slutning er kendt. Hvad man også ved om denne reaktion er, at hvert enkelt atom fra udgangsmaterialerne senere findes i produktet; kemikere kalder dette en "atom-økonomisk" reaktion. Det betyder, at i løbet af reaktionen skal hydrogenet fra N-H-bindingen passere fra benzotriazolen til det andet udgangsmateriale, allen.
Jannsen siger:"Freiburg-forskerne troede, at katalysatoren bryder nitrogen-hydrogen-bindingen, dvs. der finder en såkaldt oxidativ tilsætning af benzotriazol sted. Rhodium-katalysatorer er kendt for denne type reaktion."
Jannsen testede ideen ved først at reagere rhodiumkatalysatoren med kun ét udgangsmateriale, benzotriazol. Hun isolerede prøver fra denne reaktion til nuklear magnetisk resonansspektroskopi (NMR) og røntgenkrystalstrukturanalyse. Resultatet:"N-H-bindingen brydes slet ikke. Benzotriazolen forbliver fuldstændig intakt, den binder sig kun til katalysatoren."
Resultat:Simpel koordinering
Kemikeren opdagede derefter, at det andet udgangsstof, allen, også binder til katalysatoren. Og det er her følgende sker:"De to udgangsmaterialer kommer i direkte kontakt med hinanden, og benzotriazolen overfører hydrogenatomet, også kendt som protonen, til allenet. Katalysatoren holder blot udgangsmaterialerne på plads, men griber ikke direkte ind i dette trin."
Jannsen underbyggede derefter dette forslag i detaljer ved hjælp af kvantemekanik, dvs. ved teoretisk at modellere reaktionsvejen.
Jannsen var overrasket over, at katalysatoren klarede det hele så enkelt. For lægfolk kan det lyde lidt som et kemisk reb-trick. I tekniske termer er en sådan proces velkendt og kaldes protonering.
Denne proces havde en fordel. Jannsen siger, "Interessant nok kan reaktionsbetingelserne for protonering forbedres væsentligt ved at tilføje en anden protonkilde." For eksempel lykkedes det hende at reducere reaktionstemperaturen fra 80°C til stuetemperatur ved at tilføje en type co-katalysator.
Meget hjælper ikke altid meget
Jannsen opdagede også, at benzotriazolen også kan blokere katalysatoren under visse omstændigheder. Dette er tilfældet, når dette udgangsstof optager katalysatoren to gange, så dets reaktionspartner, allen, ikke kan finde en ledig plads på katalysatoren.
Dette lammer den katalytiske aktivitet og fører til, at katalysatoren "forbruges". "Her hjælper det nok at tilføje udgangsmaterialet til reaktionen successivt, så katalysatoren kommer i mindre kontakt med den," siger Jannsen.
Flere oplysninger: Nora Jannsen et al., The Mechanism of Rh(I)-Catalyzed Coupling of Benzotriazoles and Allenes Revisited:Substrate Inhibition, Proton Shuttling, and the Role of Cationic vs Neutral Species, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.4c02679
Journaloplysninger: Tidsskrift for American Chemical Society
Leveret af Leibniz Institute for Catalysis
 Varme artikler
Varme artikler
-
 Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u
Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u -
 Monsanto mister appel i franske landmænds forgiftningssag (opdatering)Den franske landmand Paul Francois, venstre, og hans advokat Francois Lafforgue på et pressemøde i Lyon, sydøst Frankrig, efter at en appeldomstol stadfæstede hans retssag mod Monsanto over dens Lasso
Monsanto mister appel i franske landmænds forgiftningssag (opdatering)Den franske landmand Paul Francois, venstre, og hans advokat Francois Lafforgue på et pressemøde i Lyon, sydøst Frankrig, efter at en appeldomstol stadfæstede hans retssag mod Monsanto over dens Lasso -
 Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere
Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere -
 Succes med at syntetisere bionedbrydelige plastmaterialer ved hjælp af sollys og CO2Syntet lys-drevet 3-hydroxybutyrat-produktion fra acetone og CO2:Ved hjælp af sollys og biokatalysatorer syntetiserede Osaka Metropolitan University-forskere 3-hydroxybutyrat, et biologisk nedbrydelig
Succes med at syntetisere bionedbrydelige plastmaterialer ved hjælp af sollys og CO2Syntet lys-drevet 3-hydroxybutyrat-produktion fra acetone og CO2:Ved hjælp af sollys og biokatalysatorer syntetiserede Osaka Metropolitan University-forskere 3-hydroxybutyrat, et biologisk nedbrydelig
- Art meets AI:computergenererede værker sat til salg i New York
- Ny biosensor stimulerer sved, mens patienten er kølig og hviler
- Undersøgelse om klimaændringer viser, hvordan byer kan prioritere folkesundhed
- Mikrober, der forårsager huller, kan danne superorganismer, der kan kravle og spredes på tænderne
- Mere effektiv adskillelse af metan og CO2
- Videnskabseksperimenter, der involverer kinetisk molekylær teori for gasser


