Katalysator laver lægemidler inde i kroppen for at minimere bivirkninger
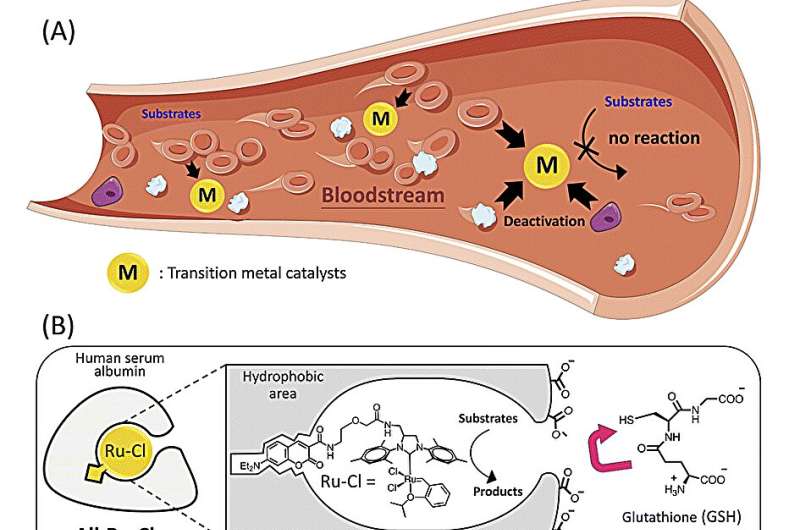
En yderst aktiv katalysator, der er i stand til at syntetisere lægemiddelmolekyler i kroppen, er blevet udviklet af RIKEN-kemikere. Hos mus undertrykte et anticancerlægemiddel, der var samlet nær tumorer ved hjælp af den injicerede katalysator, tumorvækst.
Artiklen er publiceret i tidsskriftet Chemical Science .
I konventionel medicin leveret som injektion eller pille cirkulerer det aktive lægemiddelmolekyle i hele kroppen og oversvømmer ikke kun målstedet, men også sundt væv. De resulterende bivirkninger kan være så alvorlige, at de kan forårsage permanent skade og tvinge behandlingen til at stoppe.
Samling af lægemiddelmolekyler på målsteder i kroppen kan gøre dem mere effektive og samtidig minimere deres bivirkninger.
"Den direkte syntese af lægemidler i kroppen ville gøre det muligt for lægemidler at behandle sygdomme uden at forårsage bivirkninger i sundt væv," siger Katsunori Tanaka, chefforsker ved RIKEN Biofunctional Synthetic Chemistry Laboratory. "Det er derfor, vi har brug for et biokompatibelt biokatalysesystem til at udføre lægemiddelsyntese nær målsteder i kroppen."
Holdet målrettede lægemiddelsamling i kroppen ved hjælp af en katalytisk kemisk reaktion kaldet olefinmetatese. "Olefinmetatese er en af de mest effektive metoder til at konstruere carbon-carbon dobbeltbindinger til at syntetisere lægemidler," forklarer Tanaka. "Hvis det kunne bearbejdes i kroppen, skulle det gøre os i stand til at syntetisere mange forskellige typer stoffer."
De fleste kemiske katalysatorer deaktiveres hurtigt af biomolekyler i blodbanen. For at overvinde dette problem pakkede holdet en ruthenium-baseret olefinmetatesekatalysator ind i et beskyttende protein kaldet humant serumalbumin.
Tanakas team havde tidligere vist, at et rutheniumchloridkompleks indlejret i humant serumalbumin - der danner en katalytisk samling kaldet et kunstigt metalloenzym - var noget aktivt i blodet. Nu har de vist, at skift til et rutheniumiodidkompleks producerer et langt overlegent kunstigt metalloenzym.
Ved lave katalysatorkoncentrationer katalyserede den nye albumin-baserede rutheniumiodid (AlbRuI) katalysator tre typer olefinmetatesereaktioner i blod med højt udbytte.
"AlbruI viste også robust stabilitet i 24 timer i blod," siger Tanaka. "Dette udvider biokompatibiliteten af kunstige metalloenzymer og åbner døren for udvikling af generelle, metalbaserede kunstige metalloenzymer til katalytiske reaktioner i blod."
Holdet viste også, at en lav dosis af cancer-målrettet AlbruI signifikant hæmmede tumorvækst hos mus gennem lokaliseret syntese af et antitumorlægemiddel.
Holdet har til hensigt at udvide brugen af deres katalysator. "Vi håber at bruge AlbRuI til at syntetisere en række bioaktive molekyler," siger Tanaka. "Så kunne vi bruge det til at behandle ikke kun kræft, men også andre sygdomme uden bivirkninger."
Flere oplysninger: Igor Nasibullin et al., Katalytisk olefinmetatese i blod, Chemical Science (2023). DOI:10.1039/D3SC03785A
Journaloplysninger: Kemisk videnskab
Leveret af RIKEN
 Varme artikler
Varme artikler
-
 Polymerer til undsætning! Redder celler fra at beskadige isEn simulering af et ishæmmende molekyle. Molekylet, i rødt, er som en vægt på overfladen af iskrystallen, krum den og forhindrer yderligere iskrystalvækst. Kredit:University of Utah Celleterapie
Polymerer til undsætning! Redder celler fra at beskadige isEn simulering af et ishæmmende molekyle. Molekylet, i rødt, er som en vægt på overfladen af iskrystallen, krum den og forhindrer yderligere iskrystalvækst. Kredit:University of Utah Celleterapie -
 Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer
Undersøgelse afslører korrosionsmekanisme af magnesiumlegeringer i marine atmosfærisk miljøDe optiske fotografier af mikrostruktur for Mg-5Y-1.5Nd-xZn-0.5Zr (x = 0, 2, 4, 6 wt.%) legeringer. Kredit:Journal of Magnesium and Alloys (2022). DOI:10.1016/j.jma.2022.03.007 Magnesiumlegeringer -
 Lavpris, printbar 3-D enhed designet til at analysere kemikalier fra smartphonesKredit: RSC går videre Forskere fra Universitetet i Alicante (Spanien) og Universidad Nacional del Sur (Argentina) har designet og valideret en billig 3D-printet enhed, der tilsluttet en smartpho
Lavpris, printbar 3-D enhed designet til at analysere kemikalier fra smartphonesKredit: RSC går videre Forskere fra Universitetet i Alicante (Spanien) og Universidad Nacional del Sur (Argentina) har designet og valideret en billig 3D-printet enhed, der tilsluttet en smartpho -
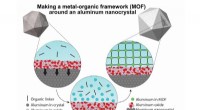 Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle
Forskere tilføjer porøs konvolut til aluminium plasmonicsEn grafik, der illustrerer syntesemetoden, der begynder med oxiddækkede aluminiumsnanokrystaller (øverst til venstre) og slutter med nanokrystallen indkapslet i metal-organisk ramme (MOF). MOFen samle
- Webs opfinder diskuterer digitale monopoler, privatlivstrusler
- TESS deler det første videnskabelige image i jagten på at finde nye verdener
- Super-jordplanet med meget kort omløbsperiode opdaget
- Første opdagelse af en naturlig topologisk isolator
- Protein opdaget inde i en meteorit
- 2016 atmosfærisk kuldioxid stiger til niveauer, der ikke ses i 800, 000 år


