Ethyne C2H2 indeholder en kulstof - tredobbelt binding Hvad er den bedste beskrivelse af denne binding?
Her er en detaljeret forklaring:
I en kulstof-kulstof tredobbelt binding deler de to kulstofatomer tre par elektroner og danner en meget stærk og stiv binding. Denne binding kan repræsenteres som C≡C.
Sigma-bindingen dannes af den frontale overlapning af de to sp-hybridiserede orbitaler, en fra hvert carbonatom. Dette resulterer i en stærk kovalent binding, der holder de to carbonatomer sammen langs den indre nukleære akse.
Ud over sigma-bindingen er der to pi-bindinger i en kulstof-kulstof tripelbinding. Pi-bindinger dannes ved sidelæns overlapning af to p-orbitaler, en fra hvert carbonatom. Disse p-orbitaler er vinkelrette på den internukleære akse og på hinanden.
Pi-bindingerne i ethyn dannes ved overlapning af de to resterende p-orbitaler på hvert kulstofatom. Disse p-orbitaler er orienteret vinkelret på sigma-bindingen og på hinanden, hvilket skaber to områder med elektrontæthed over og under sigma-bindingens plan.
Kombinationen af sigma-bindingen og de to pi-bindinger i ethyn resulterer i en meget stærk og stiv kulstof-kulstof tripelbinding. Denne binding er kortere og stærkere end en carbon-carbon-dobbeltbinding eller en carbon-carbon-enkeltbinding. Det begrænser også rotationen af de to carbonatomer omkring bindingsaksen, hvilket gør molekylet mere stift.
Tilstedeværelsen af den tredobbelte binding i ethyn giver molekylet dets unikke kemiske egenskaber og reaktivitet. Det er stærkt umættet og kan gennemgå forskellige additionsreaktioner, hvor andre atomer eller grupper af atomer kan føje til kulstof-kulstof tredobbeltbindingen, bryde pi-bindingerne og danne nye sigma-bindinger.
Sidste artikelHvad er egenskaber ved et stof?
Næste artikelAfspejler surhedsgraden af en opløsning de frie hydrogenioner i opløsning?
 Varme artikler
Varme artikler
-
 Af design:Fra affald til næste generation af kulfiberGrafisk abstrakt. Kredit:Matter (2022). DOI:10.1016/j.matt.2022.07.011 Forskning fra Washington University i St. Louis kan snart føre til lettere, stærkere kulfibermaterialer og stærkere plastik me
Af design:Fra affald til næste generation af kulfiberGrafisk abstrakt. Kredit:Matter (2022). DOI:10.1016/j.matt.2022.07.011 Forskning fra Washington University i St. Louis kan snart føre til lettere, stærkere kulfibermaterialer og stærkere plastik me -
 Prisbillig blysensor til hjemmet, byens vandledningerWen-Chi Lin viser sit elektroniske ledningssensordesign frem. Det kunne gøre det muligt for byer og husejere at lokalisere rør, der forurener vand med bly. Kredit:Evan Dougherty, Michigan Engineering
Prisbillig blysensor til hjemmet, byens vandledningerWen-Chi Lin viser sit elektroniske ledningssensordesign frem. Det kunne gøre det muligt for byer og husejere at lokalisere rør, der forurener vand med bly. Kredit:Evan Dougherty, Michigan Engineering -
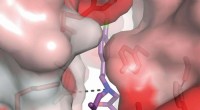 Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il
Målrettet skjult lomme til behandling af slagtilfælde og anfaldEn kemisk forbindelse i 93-serien slutter sig til en neurons NMDA-receptor. Forbindelser som denne har en høj affinitet for receptoren på grund af et unikt motiv, der trækkes ind i en skjult lomme (il -
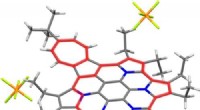 Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler
Dobbelt aromatiske ringe stabiliserer multikationerPyrrol- og azulenfusioneret azacoronen-dikering med 22π 6π aromatiske ringe. Kredit:American Chemical Society Et redoxaktivt polycyklisk aromatisk kulbrinte (PAHer) sammensat af azulen og pyrroler
- Kan lande stoppe overfiskeri og plastikforurening på kun 10 år?
- Et skridt på vejen mod bedre behandlinger mod vira
- Irans sekulære skift:Ny undersøgelse afslører enorme ændringer i religiøs overbevisning
- Ekstremerne i klimaet er nøglefaktoren bag stigende global sult:FN
- To graders opvarmning kan forårsage tørke i Middelhavsområdet
- Konservative støtter mere sandsynligt klimapolitik, hvis de rapporterer skade på grund af ekstremt…


