Hvad er en kolaventbinding?
- Forestil dig, at du har to atomer, mærket Atom A og Atom B, der hver har en elektronsky med negativt ladede elektroner, der bevæger sig rundt om deres kerner.
- Hvert atom har en bestemt elektronkonfiguration, som beskriver, hvordan elektronerne er arrangeret i forskellige energiniveauer.
- Når atomerne nærmer sig hinanden, begynder deres elektronskyer at interagere.
- Under de rette forhold kan en eller flere elektroner fra atom A blive tiltrukket af kernen i atom B, og omvendt.
- Elektronerne bliver noget delokaliserede, hvilket betyder, at de i stedet for at være begrænset til ét atom, bevæger sig i en orbital, der omfatter begge atomer.
- Denne samtidige tiltrækning af elektroner af flere kerner resulterer i dannelsen af et delt elektronpar mellem atomerne.
- Den elektrostatiske tiltrækning mellem de positivt ladede kerner og den negativt ladede elektronsky af begge atomer holder atomerne sammen og skaber en stabil kovalent binding.
Sammenfattende involverer en kovalent binding deling af et eller flere elektronpar mellem atomer, hvilket fører til en stærk kemisk binding, der holder atomerne sammen. Delingen af elektroner gør det muligt for atomerne at opnå en mere stabil konfiguration og resulterer i dannelsen af molekyler eller molekylære forbindelser.
Sidste artikelEr CH3CH2CH2OH en stærk eller svag elektrolyt?
Næste artikelHvad vil blanding af CFC-12 og HFC-134a i det samme system?
 Varme artikler
Varme artikler
-
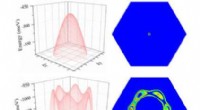 Kunne et nyt 2-D-materiale tillade, at halvledere bliver ved med at blive mindre, stærkere bedre og…I modsætning til andre materialer med elektroner, der spredes i mange retninger (nederst til venstre), elektronerne i 2D -antimon (øverst til venstre) kan fås til at bevæge sig sammen på en ordnet måd
Kunne et nyt 2-D-materiale tillade, at halvledere bliver ved med at blive mindre, stærkere bedre og…I modsætning til andre materialer med elektroner, der spredes i mange retninger (nederst til venstre), elektronerne i 2D -antimon (øverst til venstre) kan fås til at bevæge sig sammen på en ordnet måd -
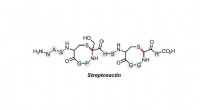 Lab opdager et lille Cain-and-Abel-molekyleStrukturen af det nyopdagede lille molekyle Streptosactin. Kredit:Leah Bushin. Et nyt bakteriemolekyle med den usmagelige tendens til at opspore og dræbe andre af sin egen art er blevet opdaget
Lab opdager et lille Cain-and-Abel-molekyleStrukturen af det nyopdagede lille molekyle Streptosactin. Kredit:Leah Bushin. Et nyt bakteriemolekyle med den usmagelige tendens til at opspore og dræbe andre af sin egen art er blevet opdaget -
 Ny kemisk modifikation af en naturlig forbindelse til kræftbehandlingGonçalo Bernardes, Principal Investigator ved iMM og medleder af undersøgelsen. Kredit:Gonçalo Ribeiro, iMM Naturlige forbindelser har ofte et lovende terapeutisk potentiale, men at bruge dem til a
Ny kemisk modifikation af en naturlig forbindelse til kræftbehandlingGonçalo Bernardes, Principal Investigator ved iMM og medleder af undersøgelsen. Kredit:Gonçalo Ribeiro, iMM Naturlige forbindelser har ofte et lovende terapeutisk potentiale, men at bruge dem til a -
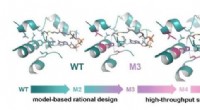 Udvidelse af grænserne for kuldioxidfikseringEngineering af glycolyl-CoA carboxylase (GCC), nøgleenzymet i TaCo-vejen. GCC blev udviklet på stilladset af en naturligt forekommende propionyl-CoA carboxylase (WT). Rationelt design førte til den 50
Udvidelse af grænserne for kuldioxidfikseringEngineering af glycolyl-CoA carboxylase (GCC), nøgleenzymet i TaCo-vejen. GCC blev udviklet på stilladset af en naturligt forekommende propionyl-CoA carboxylase (WT). Rationelt design førte til den 50
- Videnskab til børn: Hvad er de tre stater i sagen?
- Terningslanger har vist sig at bruge en række forskellige teknikker til mere effektivt at forfalske…
- Sådan fungerer krydstogtsraketter
- Værktøj forudsiger, hvor hurtigt kode vil køre på en chip
- FORKLARER:Hvorfor fusion kunne være et gennembrud af ren energi
- Glem kulstoftariffer:Eksisterende handelspolitikker giver beskidte industrier et løft


