Hvorfor opløses ammoniakmolekylet let i vand?
1. Polaritet:Ammoniak (NH3) er et polært molekyle, hvilket betyder, at det har en positiv ende (nitrogenatomet) og en negativ ende (brintatomerne). Vand er også et polært molekyle med en positiv ende (brintatomerne) og en negativ ende (iltatomet). Denne polaritet gør det muligt for ammoniakmolekyler at danne stærke hydrogenbindinger med vandmolekyler. Hydrogenbinding er en type intermolekylær kraft, der opstår, når et brintatom kovalent bundet til et meget elektronegativt atom (såsom nitrogen, oxygen eller fluor) tiltrækkes af et elektronegativt atom i et andet molekyle. I tilfælde af ammoniak og vand tiltrækkes ammoniakens brintatomer til iltatomet i vand, og nitrogenatomet i ammoniak tiltrækkes af vandets hydrogenatomer.
2. Dipol-dipol-interaktioner:Ud over hydrogenbinding oplever ammoniak- og vandmolekyler også dipol-dipol-vekselvirkninger. Dipol-dipol-interaktioner er intermolekylære kræfter, der opstår mellem polære molekyler. Den positive ende af et molekyle tiltrækkes af den negative ende af et andet molekyle og omvendt. Disse dipol-dipol-interaktioner bidrager til opløseligheden af ammoniak i vand.
3. Ionisering af ammoniak:En lille procentdel af ammoniakmolekyler i vand undergår ionisering og danner ammoniumioner (NH4+) og hydroxidioner (OH-). Denne ioniseringsproces lettes af vands høje dielektriske konstant, som er et mål for dets evne til at reducere de elektrostatiske kræfter mellem ioner. Dannelsen af ioner øger yderligere opløseligheden af ammoniak i vand.
Kombinationen af hydrogenbinding, dipol-dipol-interaktioner og ionisering gør ammoniak meget opløseligt i vand.
Sidste artikelHvad er reaktionen mellem alkoholisk KOH og alkylhalogenid?
Næste artikelHvilket grundstof findes i elektroner?
 Varme artikler
Varme artikler
-
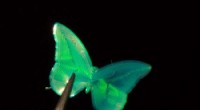 En ny flydende krystal blæk til 3D-printKredit:Eindhoven University of Technology Kolesteriske flydende krystaller, et menneskeskabt materiale med egenskaber mellem væsker og faste krystaller, kan efterligne farverne på sommerfuglevinge
En ny flydende krystal blæk til 3D-printKredit:Eindhoven University of Technology Kolesteriske flydende krystaller, et menneskeskabt materiale med egenskaber mellem væsker og faste krystaller, kan efterligne farverne på sommerfuglevinge -
 Afdækning af bakterielle cellevægshemmeligheder for at bekæmpe antibiotikaresistensI kampen mod lægemiddelresistente bakterier, Marcos Pires studerer den kemiske biologi af bakterielle celleoverflader for bedre at forstå, hvordan de fungerer - og muligvis hvordan man manipulerer dem
Afdækning af bakterielle cellevægshemmeligheder for at bekæmpe antibiotikaresistensI kampen mod lægemiddelresistente bakterier, Marcos Pires studerer den kemiske biologi af bakterielle celleoverflader for bedre at forstå, hvordan de fungerer - og muligvis hvordan man manipulerer dem -
 Få mest muligt ud af spinat - maksimering af antioxidanten luteinSpinat plante, Castelltallat, Catalonien. Kredit:Victor M. Vicente Selvas / public domain Spis din spinat i form af en smoothie eller juice – dette er den bedste måde at opnå antioxidanten lutein
Få mest muligt ud af spinat - maksimering af antioxidanten luteinSpinat plante, Castelltallat, Catalonien. Kredit:Victor M. Vicente Selvas / public domain Spis din spinat i form af en smoothie eller juice – dette er den bedste måde at opnå antioxidanten lutein -
 Energiforskere opfinder fejlfrie katalysatorerForskere ved Catalysis Center for Energy Innovation opfandt katalysatorteknologi, der kan accelerere kemiske reaktioner ved hjælp af bølger. Den banebrydende teknologi kan indarbejdes i hundredvis af
Energiforskere opfinder fejlfrie katalysatorerForskere ved Catalysis Center for Energy Innovation opfandt katalysatorteknologi, der kan accelerere kemiske reaktioner ved hjælp af bølger. Den banebrydende teknologi kan indarbejdes i hundredvis af
- Hvordan udvindes granit?
- Hvorfor stater skubber frem med ren energi på trods af Trumps omfavnelse af kul
- Henfalder protoner? Svaret kan være på månen
- Denisovans eller Homo sapiens:Hvem var de første, der bosatte sig permanent på det tibetanske plat…
- Sådan bruges et 9 Volt batteri til Power LEDs
- Hvad blokkerer enzymaktiviteten ved at binde til det aktive site af et enzym?


