Hvorfor er jod mindre reaktivt end brom?
1. Atomstørrelse: Jod har en større atomstørrelse end brom. Efterhånden som atomstørrelsen øges, øges også afstanden mellem kernen og de yderste elektroner. Dette resulterer i et fald i den effektive kerneladning, som de yderste elektroner oplever. Som et resultat er de yderste elektroner i jod mere løst holdt og mindre reaktive sammenlignet med brom.
2. Polariserbarhed: Polariserbarhed er et atoms eller molekyles evne til at deformere sin elektronsky som reaktion på et eksternt elektrisk felt. Jod er mindre polariserbart end brom. Det betyder, at elektronskyen af jod er mere fastholdt og mindre modtagelig for forvrængning. Som et resultat er jod mindre reaktivt over for elektrofiler (arter, der tiltrækkes af elektroner) sammenlignet med brom.
3. Bonddissociationsenergi: Bindingsdissociationsenergien for jod er større end broms. Det betyder, at der kræves mere energi for at bryde I-I-bindingen i jod sammenlignet med Br-Br-bindingen i brom. Som følge heraf er det mindre sandsynligt, at jod gennemgår homolytisk bindingsspaltning, hvilket er en fælles reaktionsvej for mange kemiske reaktioner.
Sammenfattende bidrager jods større atomstørrelse, lavere polariserbarhed og højere bindingsdissociationsenergi til dets reducerede reaktivitet sammenlignet med brom.
 Varme artikler
Varme artikler
-
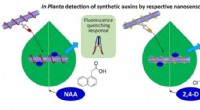 Forskere designer sensorer til hurtigt at opdage plantehormonerNanosensorer udviklet ved Singapore-MIT Alliance for Research and Technology (SMART) kan detektere syntetiske auxin plantehormoner NAA og 2, 4-D. Kredit:Singapore-MIT Alliance for Research and Technol
Forskere designer sensorer til hurtigt at opdage plantehormonerNanosensorer udviklet ved Singapore-MIT Alliance for Research and Technology (SMART) kan detektere syntetiske auxin plantehormoner NAA og 2, 4-D. Kredit:Singapore-MIT Alliance for Research and Technol -
 Elektronisk signal udvider materialet med en faktor på 100Eleni Stavrinidou, Johannes Gladisch og Magnus Berggren med det nye materiale. Kredit:Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköping Universitet, har opdaget et materiale,
Elektronisk signal udvider materialet med en faktor på 100Eleni Stavrinidou, Johannes Gladisch og Magnus Berggren med det nye materiale. Kredit:Thor Balkhed Forskere ved Laboratory of Organic Electronics, Linköping Universitet, har opdaget et materiale, -
 Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v
Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v -
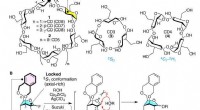 Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
- Intet ser godt ud til at forberede sommerens naturbrandsæson
- For meget smil i en salgstale kunne dræbe handlen
- Ti-årig dreng hjælper paleontologer med at opdage gamle fiskearter
- Stor udendørs undersøgelse viser, at biodiversitet forbedrer stabiliteten af algebiobrændstofsy…
- Hvorfor er det ikke miljøvenligt at gå ind for økonomisk vækst
- Hvad er asteroider lavet af?


