Hvad er fordelen ved kovalent binding frem for ionisk, når man laver store molekyler?
1. Større stabilitet: Kovalente bindinger er generelt stærkere end ionbindinger på grund af deling af elektroner mellem atomer. Denne stærkere binding fører til øget stabilitet og stivhed i store molekyler.
2. Retningsbestemt natur: Kovalente bindinger har specifikke orienteringer og geometrier, hvilket giver mulighed for præcise molekylære strukturer. Denne retningsbestemte natur muliggør dannelsen af komplekse og veldefinerede tredimensionelle strukturer, essentielle for de indviklede funktioner af store molekyler som proteiner og nukleinsyrer.
3. Alsidige interaktioner: Kovalente bindinger kan dannes mellem forskellige typer atomer, herunder ikke-metaller og metalloider, hvilket giver større fleksibilitet i molekylær sammensætning. Denne alsidighed giver mulighed for at skabe en bred vifte af molekyler med forskellige egenskaber og funktionaliteter.
4. Effektiv pakning: Kovalente molekyler kan ofte pakke mere effektivt end ioniske molekyler på grund af fraværet af stærke elektrostatiske tiltrækninger mellem modsat ladede ioner. Denne effektive pakning er afgørende for at danne kompakte og stabile molekylære strukturer.
5. Elektrisk neutralitet: Kovalente molekyler er elektrisk neutrale, hvilket betyder, at de ikke bærer en nettoladning. Denne neutralitet eliminerer behovet for at balancere positive og negative ladninger, hvilket forenkler samlingen af store molekyler.
6. Lavere reaktivitet: Kovalente molekyler er generelt mindre reaktive end ioniske molekyler. Denne reducerede reaktivitet hjælper med at forhindre uønskede interaktioner og giver stabilitet til store molekyler, især i biologiske systemer.
Sammenfattende giver kovalent binding større stabilitet, retningsbestemte egenskaber, alsidighed, effektiv pakning, elektrisk neutralitet og lavere reaktivitet, hvilket gør det fordelagtigt til konstruktion af store og komplekse molekyler, der er afgørende for liv og forskellige teknologiske anvendelser.
 Varme artikler
Varme artikler
-
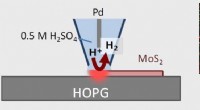 Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers
Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers -
 Klistermærker og en smartphone til nem nitritpåvisning på fødevarerEn ny film reagerer på nitritanioner gennem en farveændring, der bliver mørkere med højere nitritniveauer. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2022, DOI:10.1021/acsami.2c09467 Ni
Klistermærker og en smartphone til nem nitritpåvisning på fødevarerEn ny film reagerer på nitritanioner gennem en farveændring, der bliver mørkere med højere nitritniveauer. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2022, DOI:10.1021/acsami.2c09467 Ni -
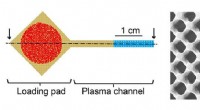 Ny teststrimmel bevarer spor, som blodprøver ofte savnerFilterets layout og et nærbillede af overfladedetaljen. Koagulerede blodlegemer er angivet med rødt. Plasma, der fylder kanalen, er angivet med gult. Og den blå sektion indikerer den tomme rest af kan
Ny teststrimmel bevarer spor, som blodprøver ofte savnerFilterets layout og et nærbillede af overfladedetaljen. Koagulerede blodlegemer er angivet med rødt. Plasma, der fylder kanalen, er angivet med gult. Og den blå sektion indikerer den tomme rest af kan -
 Graphen-omviklede zeolitmembraner til hurtig hydrogenseparationFigur 1. Transmissionselektronmikrofotografi af grafenindpakket zeolit. Kredit:Forfatterne Effekterne af den globale opvarmning bliver mere alvorlige, og der er en stærk efterspørgsel efter teknolo
Graphen-omviklede zeolitmembraner til hurtig hydrogenseparationFigur 1. Transmissionselektronmikrofotografi af grafenindpakket zeolit. Kredit:Forfatterne Effekterne af den globale opvarmning bliver mere alvorlige, og der er en stærk efterspørgsel efter teknolo
- Forskere kortlægger det tidligste islandske genom
- Digitale teknologiers rolle i mobiliseringen af alt-right
- Velegnet til Mars
- At undersøge et uudforsket rum med svære problemer, forskere spiller djævlens advokat
- Layered footballs:Første todimensionale organiske metal lavet af fullerener
- Hvorfor er svovlbrinte en gas ved stuetemperatur?


