Hvilket subatomare bestemmer atomernes kemiske egenskaber og hvorfor?
1. Elektronkonfiguration :Ordningen af elektroner i et atoms energiniveauer, kendt som elektronkonfigurationen, bestemmer atomets kemiske adfærd. De yderste elektroner, kaldet valenselektroner, er de mest involverede i kemiske reaktioner. Atomer med lignende elektronkonfigurationer har en tendens til at have lignende kemiske egenskaber.
2. Elektronegativitet :Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv. Atomer med høj elektronegativitet har en tendens til at trække elektroner væk fra andre atomer og danner ionbindinger. Atomer med lav elektronegativitet opgiver let deres elektroner og danner kovalente bindinger.
3. Valenselektroner :Valenselektroner er elektronerne i et atoms yderste energiniveau. De deltager i kemisk binding ved enten at overføre (i ionbindinger) eller dele (i kovalente bindinger) med andre atomer. Antallet af valenselektroner bestemmer et atoms valens, hvilket er afgørende for dannelse af stabile kemiske forbindelser.
4. Kemisk binding :Kemiske bindinger dannes, når atomer interagerer for at opnå en stabil elektronkonfiguration. Den dannede kemiske binding afhænger af elektronkonfigurationen og elektronegativiteten af de involverede atomer. Kovalente bindinger skyldes deling af elektroner, mens ionbindinger opstår ved fuldstændig overførsel af elektroner.
5. Reaktivitet :Et atoms reaktivitet påvirkes af dets elektronkonfiguration. Atomer med lav ioniseringsenergi (let aftagelige valenselektroner) og høje elektronaffiniteter (stærk tiltrækning for elektroner) har en tendens til at være mere reaktive. Denne reaktivitet bestemmer, hvordan et atom interagerer med andre atomer og danner kemiske forbindelser.
Sammenfattende bestemmer antallet af valenselektroner, elektronegativiteten og elektronkonfigurationen et atoms kemiske egenskaber. Disse faktorer dikterer, hvordan atomer interagerer med hinanden og danner forskellige typer kemiske bindinger og forbindelser. Forståelse af elektronadfærd og elektronkonfigurationer giver grundlag for at forudsige og forklare grundstoffers og forbindelsers kemiske egenskaber.
 Varme artikler
Varme artikler
-
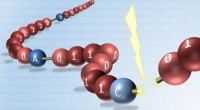 Verdens første til at læse digitalt kodede syntetiske molekylerVed at indsætte skrøbelige bindinger mellem hver molekylær byte, digitale polymerer kan let aflæses gennem massespektrometri. Kredit:Jean-François Lutz, Institut Charles Sadron (CNRS) Ved hjælp af
Verdens første til at læse digitalt kodede syntetiske molekylerVed at indsætte skrøbelige bindinger mellem hver molekylær byte, digitale polymerer kan let aflæses gennem massespektrometri. Kredit:Jean-François Lutz, Institut Charles Sadron (CNRS) Ved hjælp af -
 Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide
Forskere tilføjer orden til polymergelerEn prøve af den nye homogene polymergel. Kredit:© 2019 Li et al. Gel-lignende materialer har en lang række anvendelser, især inden for kemi og medicin. Imidlertid, deres anvendelighed er undertide -
 Hvor meget gryde i den brownie? Chokolade kan afvise testsI denne fredag, 16. august, 2019, Foto, kemiker David Dawson holder et hætteglas op med en ekstraheret chokoladebar, der er inficeret med cannabis, da han demonstrerer test for THC og andre kemikalier
Hvor meget gryde i den brownie? Chokolade kan afvise testsI denne fredag, 16. august, 2019, Foto, kemiker David Dawson holder et hætteglas op med en ekstraheret chokoladebar, der er inficeret med cannabis, da han demonstrerer test for THC og andre kemikalier -
 Læskedrikkebiprodukter kan reducere den globale opvarmningKredit:CC0 Public Domain Professor i kemi Craig Teague og hans studerende har opdaget, at biprodukterne fra læskedrikke kan hjælpe med at reducere den globale opvarmning. Et team af forskere fra
Læskedrikkebiprodukter kan reducere den globale opvarmningKredit:CC0 Public Domain Professor i kemi Craig Teague og hans studerende har opdaget, at biprodukterne fra læskedrikke kan hjælpe med at reducere den globale opvarmning. Et team af forskere fra
- Hvorfor det ikke kan betale sig bare at være sød – du skal også være intelligent
- En bysamling af moderne mikrometeoritter
- Støv op på International Space Station antyder kilder til struktur
- Forskning undersøger årsagerne til fald i havniveauet i Det Døde Hav
- En dag til at fejre kemiens yndlingsenhed - muldvarpen. Men hvad er en muldvarp?
- Hvorfor amerikanerne bliver i stedet for at flytte til en ny by eller stat


