Hvorfor deler grundstofferne i gruppe 16 lignende kemiske egenskaber?
Grundstofferne i gruppe 16 har alle seks valenselektroner. Det betyder, at de alle kan danne kovalente bindinger med andre atomer ved at dele deres valenselektroner. De kan også danne ionbindinger ved at miste eller få elektroner.
Ligheden i antallet af valenselektroner blandt grundstofferne i gruppe 16 giver dem lignende kemiske egenskaber, såsom:
* De er alle ikke-metalliske.
* De har alle lav elektronegativitet.
* De danner alle kovalente bindinger med andre atomer.
* De kan alle danne ionbindinger ved at miste eller få elektroner.
* De reagerer alle med ilt og danner oxider.
* De reagerer alle med brint og danner hydrider.
Elementerne i gruppe 16 er:
* Ilt (O)
* Svovl (S)
* Selen (Se)
* Tellur (Te)
* Polonium (Po)
Disse elementer bruges alle i en række forskellige applikationer, såsom:
* Ilt bruges til fremstilling af stål, plast og gødning.
* Svovl bruges til fremstilling af svovlsyre, som bruges i en række forskellige industrier, såsom gødningsindustrien og olieindustrien.
* Selen bruges til fremstilling af halvledere og solceller.
* Tellur bruges til fremstilling af halvledere og legeringer.
* Polonium bruges som en kilde til alfapartikler i atomkraftværker og i medicinske applikationer.
Sidste artikelHvilken kraft holder atomer sammen i forbindelser?
Næste artikelHvordan holder kemisk energi molekyler sammen?
 Varme artikler
Varme artikler
-
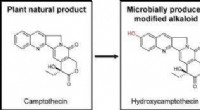 Mikrober kunne gøre medicinproduktionen mere effektivAlkaloidbaserede lægemidler afledt af planter kan være potente behandlinger for en række forskellige sygdomme. Men at få disse kraftfulde terapeutiske midler fra planter kan tage lang tid og koste man
Mikrober kunne gøre medicinproduktionen mere effektivAlkaloidbaserede lægemidler afledt af planter kan være potente behandlinger for en række forskellige sygdomme. Men at få disse kraftfulde terapeutiske midler fra planter kan tage lang tid og koste man -
 Elektronkrystallografi viste sig at virke lige så godt som røntgenkrystallografi kun på mindre kr…Identifikation af forbindelser fra heterogene blandinger. EM-gitter forberedt som ovenfor med biotin, brucine, carbamazepin, og cinchoninpulver blandet sammen. Alle fire forbindelser identificeret ved
Elektronkrystallografi viste sig at virke lige så godt som røntgenkrystallografi kun på mindre kr…Identifikation af forbindelser fra heterogene blandinger. EM-gitter forberedt som ovenfor med biotin, brucine, carbamazepin, og cinchoninpulver blandet sammen. Alle fire forbindelser identificeret ved -
 Placering af appelsinskalolie til nye, behagelige aromaforbindelserKredit:Pixabay/CC0 Public Domain Når appelsiner skrælles, sprøjter de en syrlig, citrusduftende olie ud i luften. Hovedforbindelsen i dufttågen er limonen, som kan opsamles fra kasserede skræller o
Placering af appelsinskalolie til nye, behagelige aromaforbindelserKredit:Pixabay/CC0 Public Domain Når appelsiner skrælles, sprøjter de en syrlig, citrusduftende olie ud i luften. Hovedforbindelsen i dufttågen er limonen, som kan opsamles fra kasserede skræller o -
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
- Amerikanske tilskud øger det forventede overskud og udviklingen af nye olie- og gasfelter
- Hvordan er de lysogene og lytiske cyklusser forskellige?
- Team udvikler nanoskop til at undersøge kemi på molekylær skala
- Varmere Arktis skader afgrøder i USA, Canada:undersøgelse
- Gearing op for at spore pladsaffald
- Højhastighedsbilleder kaster lys over, hvordan metaller fejler


