Hvorfor elektrolyseres de kovalente forbindelser ikke?
I kovalente forbindelser er atomer bundet sammen ved at dele elektroner og danner stærke kovalente bindinger. Disse elektroner er lokaliseret mellem atomerne og kan ikke bevæge sig frit, hvilket hæmmer dannelsen af mobile ioner. Som et resultat eksisterer kovalente forbindelser som neutrale molekyler og dissocierer ikke til ioner.
I modsætning hertil opløses ioniske forbindelser, såsom natriumchlorid (NaCl), let i vand eller smelter for at danne opløsninger eller smeltede tilstande, der indeholder frit bevægelige ioner. Disse ioner, såsom natrium (Na+) og chlorid (Cl-) ioner i tilfælde af NaCl, kan bære elektrisk strøm, hvilket gør ioniske forbindelser egnede til elektrolyse.
Når en elektrisk strøm ledes gennem en opløsning eller smeltet ionforbindelse, tiltrækkes ionerne til de modsat ladede elektroder. Positive ioner (kationer) migrerer mod den negative elektrode (katode), og negative ioner (anioner) bevæger sig mod den positive elektrode (anode). Denne bevægelse af ioner tillader kemiske reaktioner at forekomme ved elektroderne, hvilket resulterer i nedbrydning eller transformation af forbindelsen.
Sammenfattende gennemgår kovalente forbindelser ikke elektrolyse, fordi de mangler frie ioner til at lede elektricitet. Elektrolyse er typisk anvendelig til ioniske forbindelser eller visse smeltede salte, der indeholder mobile ioner.
 Varme artikler
Varme artikler
-
 Ny ledende belægning kan frigøre fremtidens biometriske og bærbare teknologiFig. 1. Strukturelle og morfologiske karakteriseringer af MXene -flerlag. (A) skematisk af PDAC/MXene LbL -samlingsprocessen. Billeder af (B) nedsænkning AQ48 og (C) spraysamling af flerlagsbelægninge
Ny ledende belægning kan frigøre fremtidens biometriske og bærbare teknologiFig. 1. Strukturelle og morfologiske karakteriseringer af MXene -flerlag. (A) skematisk af PDAC/MXene LbL -samlingsprocessen. Billeder af (B) nedsænkning AQ48 og (C) spraysamling af flerlagsbelægninge -
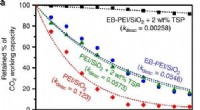 Forskere producerer 50x mere stabilt adsorbentKuldioxid arbejdskapacitet mod oxidativ ældningstid. Udførelsen af den foreslåede metode (sort) forringes meget langsommere (~ 50x) end eksisterende metoder. Det nye adsorbent er således vist at vær
Forskere producerer 50x mere stabilt adsorbentKuldioxid arbejdskapacitet mod oxidativ ældningstid. Udførelsen af den foreslåede metode (sort) forringes meget langsommere (~ 50x) end eksisterende metoder. Det nye adsorbent er således vist at vær -
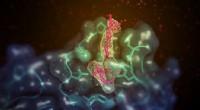 Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S
Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S -
 Kemikere opdager en nøgle til grønnere fødevareproduktionSkinnende blåt lys på iridium gør det “ophidset, ”Giver den energi til at støde ind i antracenmolekylet og overføre et hydrogenatom, danner et svagt bånd. Iridiumkatalysatoren aktiverer derefter hydro
Kemikere opdager en nøgle til grønnere fødevareproduktionSkinnende blåt lys på iridium gør det “ophidset, ”Giver den energi til at støde ind i antracenmolekylet og overføre et hydrogenatom, danner et svagt bånd. Iridiumkatalysatoren aktiverer derefter hydro
- Syrer og baser fundet i hjem
- Ulovlige afbrydelser reducerer produktiviteten på arbejdspladsen, finder undersøgelse
- Hvordan socioøkonomiske faktorer kan påvirke spredningen af invasive planter
- Opmærksom på skiløbere:Forskere vil have din hjælp
- Hvad er en kovalent forbindelse, der opløses i vand?
- Ingen undslippende havplastik:37 millioner stumper affald på en af verdens fjerneste øer


