Hvad er valensen af et grundstof eller radikal?
For hovedgruppeelementer (Gruppe 1 til 18 i det periodiske system) er valensen typisk lig med gruppetallet. For eksempel har elementer i gruppe 1 en valens på 1, elementer i gruppe 2 har en valens på 2, og så videre.
Her er en mere detaljeret forklaring af valens for forskellige typer elementer:
1. Metaller:Metaller har generelt lav ioniseringsenergi og har tendens til at miste elektroner for at opnå en stabil elektronkonfiguration. Valensen af metaller svarer til antallet af valenselektroner, de besidder. Alkalimetaller (Gruppe 1) har en valenselektron, jordalkalimetaler (Gruppe 2) har to valenselektroner, og overgangsmetaller har typisk variable valenstilstande.
2. Ikke-metaller:Ikke-metaller har højere ioniseringsenergier sammenlignet med metaller og har tendens til at få elektroner for at opnå en stabil konfiguration. Deres valens bestemmes ved at overveje, hvor mange elektroner de skal få for at fuldføre deres yderste energiniveau. For eksempel har grundstoffer i gruppe 17 (halogener) en valens på 7, fordi de har brug for at få en elektron for at færdiggøre deres ydre skal.
3. Radikaler:Radikaler er atomer eller molekyler med uparrede elektroner. Valensen af et radikal refererer til antallet af elektroner, det kan vinde eller tabe for at opnå en stabil konfiguration. Dette kan være forskelligt fra valensen af selve elementet. For eksempel har methylradikalet (CH3) en valens på 3, da det har tre uparrede elektroner.
Det er værd at bemærke, at valens også kan påvirkes af den kemiske kontekst og de specifikke forbindelser et grundstof eller radikal danner. Derudover kan elementer udvise variable valenser i forskellige forbindelser, afhængigt af deres bindingspræferencer og de oxidationstilstande, de kan vedtage. At forstå grundstoffernes valens er afgørende for at forudsige kemisk adfærd, bestemme elektronkonfigurationer og afbalancere kemiske ligninger.
 Varme artikler
Varme artikler
-
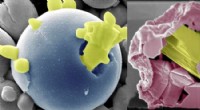 Metal hvisken:At finde en bedre måde at genvinde ædle metaller fra elektronisk affaldNy teknologi udviklet af Iowa State ingeniører bruger varme og oxidation til at genvinde rene og ædle metaller fra elektronisk affald. Det virker på to måder - det kan bringe de mest reaktive komponen
Metal hvisken:At finde en bedre måde at genvinde ædle metaller fra elektronisk affaldNy teknologi udviklet af Iowa State ingeniører bruger varme og oxidation til at genvinde rene og ædle metaller fra elektronisk affald. Det virker på to måder - det kan bringe de mest reaktive komponen -
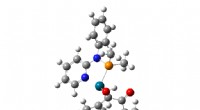 Supercomputering af kemiske reaktionerAnimation, der viser den laveste energiovergangstilstand for dannelsen af cyclopentenoner, som findes i et stort antal naturlige produkter, herunder jasminolier, aflatoksiner, og flere prostaglandin
Supercomputering af kemiske reaktionerAnimation, der viser den laveste energiovergangstilstand for dannelsen af cyclopentenoner, som findes i et stort antal naturlige produkter, herunder jasminolier, aflatoksiner, og flere prostaglandin -
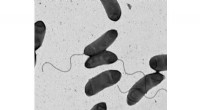 En usædvanlig form for antibiotikaresistens ved pandemisk koleraBilledet er et elektronmikrografi af bakterien Vibrio kolerae , det forårsagende middel til koleraen. Kredit:M. Stephen Trent, University of Georgia Kolera er en ødelæggende sygdom for millioner
En usædvanlig form for antibiotikaresistens ved pandemisk koleraBilledet er et elektronmikrografi af bakterien Vibrio kolerae , det forårsagende middel til koleraen. Kredit:M. Stephen Trent, University of Georgia Kolera er en ødelæggende sygdom for millioner -
 Smartphone-sensorer er i stand til at detektere hash høj og har potentiale til at yde tidlig interv…Kredit:CC0 Public Domain Smartphone-sensorer bruges dagligt til at registrere tid og rejser, men når disse to faktorer kombineres, forskere fandt ud af, at disse sensorer også kan detektere en can
Smartphone-sensorer er i stand til at detektere hash høj og har potentiale til at yde tidlig interv…Kredit:CC0 Public Domain Smartphone-sensorer bruges dagligt til at registrere tid og rejser, men når disse to faktorer kombineres, forskere fandt ud af, at disse sensorer også kan detektere en can
- Sådan fortæller du forskellen mellem talkum og gips
- Forhistoriske kvinder havde stærkere arme end nutidens elite -ro -besætninger
- Et spring fremad for design af biomaterialer ved hjælp af AI
- En oversvømmet Everglades:Velsignelse for fugle, men højt vand truer nogle arter
- Klimaforandringerne driver skovbrande, og ikke kun i Californien
- Selvbyggende 3D-printede klodser antyder fremtiden uden samlebånd


