Hvad sker der, når svovl reagerer med varm og koncentreret svovlsyre?
S + 2H2S04 → 3S02 + 2H2O
I denne reaktion oxideres svovlatomer (S) fra en oxidationstilstand nul til en +4 oxidationstilstand i svovldioxid (SO2), mens hydrogenatomerne (H) i svovlsyre (H2SO4) reduceres fra en +1 oxidationstilstand til en nul-oxidationstilstand i vand (H2O).
Svovldioxidgas frigives som en farveløs gas med en skarp lugt. Den varme og koncentrerede svovlsyreopløsning tjener som både en reaktant og et reaktionsmedium, hvilket giver de nødvendige betingelser for oxidation af svovl. Denne reaktion bruges ofte i den industrielle produktion af svovldioxid, som efterfølgende anvendes i forskellige applikationer såsom raffinering af petroleum, produktion af papir og som blegemiddel i tekstilindustrien.
Sidste artikelKan du se et molekyle med det blotte øje?
Næste artikelJern carbon og neon er alle eksempler på hvad?
 Varme artikler
Varme artikler
-
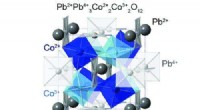 Blandede valenstilstande i blyperovskitterKrystalstruktur af Pb2+Pb4+3Co2+2Co3+2O12, hvor Pb og Co har ladningsordener på trods af den simple PbCoO3-kemiske sammensætning og valensfordelingsændringer for PbMO3 (M:3d overgangsmetal). Kredit: J
Blandede valenstilstande i blyperovskitterKrystalstruktur af Pb2+Pb4+3Co2+2Co3+2O12, hvor Pb og Co har ladningsordener på trods af den simple PbCoO3-kemiske sammensætning og valensfordelingsændringer for PbMO3 (M:3d overgangsmetal). Kredit: J -
 Meget effektiv enkeltatom-katalysator kan hjælpe bilindustrienSingle-atom platin (blå kugle) belagt guld (gul kugle) nanopartikler kan tjene som en yderst effektiv katalysator for en brændselscelle kemisk reaktion (dvs. myresyreoxidation). Kredit:Canadian Light
Meget effektiv enkeltatom-katalysator kan hjælpe bilindustrienSingle-atom platin (blå kugle) belagt guld (gul kugle) nanopartikler kan tjene som en yderst effektiv katalysator for en brændselscelle kemisk reaktion (dvs. myresyreoxidation). Kredit:Canadian Light -
 Nøglen er i belægningen:Flerlagsbelægning for at forbedre korrosionsbestandigheden af stålFlerlagsbelægningen har vist høj modstandsdygtighed over for rust og kan have vidtrækkende konsekvenser på byggeområdet. Kredit:Korea Maritime &Ocean University Stålets styrke gør det til et af de
Nøglen er i belægningen:Flerlagsbelægning for at forbedre korrosionsbestandigheden af stålFlerlagsbelægningen har vist høj modstandsdygtighed over for rust og kan have vidtrækkende konsekvenser på byggeområdet. Kredit:Korea Maritime &Ocean University Stålets styrke gør det til et af de -
 Forskere rapporterer 3-D-printet latexgummi gennembrudEn tværfaglig gruppe af forskere i kemi og maskinteknik udviklede en ny proces til 3D-print af latexgummi. Latex gummidele, såsom dette pumpehjul printet ved 100 mikron opløsning, tillade ikke-destruk
Forskere rapporterer 3-D-printet latexgummi gennembrudEn tværfaglig gruppe af forskere i kemi og maskinteknik udviklede en ny proces til 3D-print af latexgummi. Latex gummidele, såsom dette pumpehjul printet ved 100 mikron opløsning, tillade ikke-destruk
- Er logningen virkelig stoppet i Victoria? Hvad et truet svæveflys død fortæller os
- Bider i sin egen hale:Nanocontainer med integreret kontakt
- Ja, luften var bedre under lockdown, undersøgelse viser
- Foruroligende omfang af plastikforurening afsløret
- Hvad ulves tænder afslører om deres liv
- Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer


