Hvad fører til stigningen i hastigheden af en kemisk reaktion?
1. Temperatur:Når temperaturen stiger, stiger den gennemsnitlige kinetiske energi af reaktantmolekylerne. Det betyder, at de bevæger sig hurtigere og kolliderer med hinanden hyppigere og med mere energi, hvilket øger chancerne for en vellykket reaktion.
2. Koncentration:Forøgelse af koncentrationen af reaktanterne betyder, at der er flere reaktantmolekyler til stede i et givet volumen. Dette øger sandsynligheden for kollisioner mellem reaktantmolekyler og følgelig reaktionshastigheden.
3. Overfladeareal:Forøgelse af overfladearealet af faste eller flydende reaktanter øger antallet af partikler, der udsættes for hinanden og er tilgængelige for reaktion. Dette kan fremskynde reaktionshastigheden betydeligt.
4. Katalysator:En katalysator er et stof, der fremskynder en kemisk reaktion uden at blive forbrugt i processen. Katalysatorer sænker reaktionens aktiveringsenergi, hvilket gør det lettere for reaktanter at nå overgangstilstanden og danne produkter.
5. Lys:I fotokemiske reaktioner absorberes lysenergi af reaktantmolekyler, hvilket fremmer dem til en exciteret tilstand. Disse exciterede molekyler er mere reaktive og kan lettere undergå reaktioner, hvilket øger reaktionshastigheden.
6. Tryk:For reaktioner, der involverer gasser, kan stigende tryk øge reaktionshastigheden ved at tvinge flere reaktantmolekyler tættere på hinanden og øge hyppigheden af kollisioner.
7. Enzymer:I biokemiske reaktioner fungerer enzymer som katalysatorer for at accelerere hastigheden af specifikke reaktioner. De binder sig til reaktanterne og danner et enzym-substratkompleks og sænker den aktiveringsenergi, der kræves for at reaktionen kan finde sted.
8. Ionstyrke:For reaktioner, der involverer ioner i opløsning, kan forøgelse af opløsningens ionstyrke påvirke reaktionshastigheden ved at påvirke ionernes aktivitet og interaktioner.
Det er vigtigt at bemærke, at disse faktorer kan have forskellige virkninger på forskellige reaktioner, og den specifikke påvirkning afhænger af reaktionens art og betingelserne, hvorunder den opstår.
 Varme artikler
Varme artikler
-
 Forskere skaber lokkemaling, der lurer infrarøde kameraerBogstaverne C-A-L fremstår seje, selvom miljøet er varmt. UC Berkeley -ingeniører udvikler et lokkedue, der lader infrarøde kameraer til at opfatte en bestemt temperatur frem for objektets faktiske te
Forskere skaber lokkemaling, der lurer infrarøde kameraerBogstaverne C-A-L fremstår seje, selvom miljøet er varmt. UC Berkeley -ingeniører udvikler et lokkedue, der lader infrarøde kameraer til at opfatte en bestemt temperatur frem for objektets faktiske te -
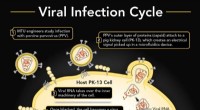 Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir
Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir -
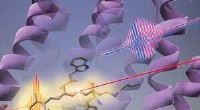 Proteinændringer går forud for fotoisomerisering af retinal kromoforFigur 1:RIKEN-forskere har fundet ud af, at lys (lang rød linje) først får proteinets form (lilla hvirvler) til at ændre sig, før den retinale kromofor (stick-lignende struktur) i bacteriorhodopsin ge
Proteinændringer går forud for fotoisomerisering af retinal kromoforFigur 1:RIKEN-forskere har fundet ud af, at lys (lang rød linje) først får proteinets form (lilla hvirvler) til at ændre sig, før den retinale kromofor (stick-lignende struktur) i bacteriorhodopsin ge -
 Forbedring af katalysatoren, der omdanner metan til syngasKredit:shutterstock Hokkaido University forskere har skabt en forbedret katalysator til omdannelse af metangas til syngas, en forløber for flydende brændstoffer og grundlæggende kemikalier. Synga
Forbedring af katalysatoren, der omdanner metan til syngasKredit:shutterstock Hokkaido University forskere har skabt en forbedret katalysator til omdannelse af metangas til syngas, en forløber for flydende brændstoffer og grundlæggende kemikalier. Synga
- Hylde fremtidens taxa:Drone-car mashup-model tager flugten
- Ja, kunder kan godt lide det, når tjenere og frisører bærer en maske – især hvis den er sort
- Mystiske mikroproteiner har store konsekvenser for menneskelig sygdom
- NASA ser den kompakte orkan Hilary
- Påberåber sig æren for cyberangreb
- En solillusion:Koronale løkker er måske ikke, hvad de ser ud til


