Hvorfor reagerer quinuclidin hurtigere end triethylamin med isopropylchlorid i en SN2-reaktion?
1. Nukleofilicitet: Quinuclidin er en stærkere nukleofil end triethylamin. Dette skyldes, at nitrogenatomet i quinuclidin er mere basisk end nitrogenatomet i triethylamin. Jo mere grundlæggende nitrogenatomet er, jo lettere kan det donere et par elektroner for at danne en ny binding.
2. Sterisk hindring: Triethylamin er et mere omfangsrigt molekyle end quinuclidin. Det betyder, at de tre ethylgrupper i triethylamin skaber mere sterisk hindring omkring nitrogenatomet, hvilket gør det sværere for nitrogenatomet at reagere med isopropylchloridet. Quinuclidin er på den anden side et mindre molekyle med mindre sterisk hindring, hvilket gør det muligt for nitrogenatomet at reagere lettere med isopropylchloridet.
3. Opløsningsmiddeleffekter: Reaktionen mellem quinuclidin og isopropylchlorid udføres typisk i et polært aprotisk opløsningsmiddel, såsom dimethylformamid (DMF). DMF er et godt opløsningsmiddel til denne reaktion, fordi det kan opløse både nukleofilen og elektrofilen, og det forstyrrer ikke reaktionen. Triethylamin er på den anden side en dårlig nukleofil i polære aprotiske opløsningsmidler. Dette skyldes, at de polære aprotiske opløsningsmiddelmolekyler konkurrerer med triethylaminen om isopropylchloridet, hvilket reducerer koncentrationen af triethylamin-isopropylchloridkomplekset og sænker reaktionen.
Sammenfattende reagerer quinuclidin hurtigere end triethylamin med isopropylchlorid i en SN2-reaktion, fordi det er en stærkere nukleofil, det har mindre sterisk hindring, og det er mere opløseligt i reaktionsopløsningsmidlet.
Sidste artikelEr Na-atom ion eller molekyle?
Næste artikelHvad fører til stigningen i hastigheden af en kemisk reaktion?
 Varme artikler
Varme artikler
-
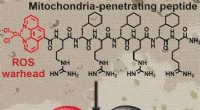 Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p
Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p -
 Undersøgelse bruger neutroner til at skinne lys på lukning af kræftcellerSt. Jude-forsker Eric Gibbs klargør prøver til neutroneksperimenter for at studere forskellige sammensætninger af en proteintumorsuppressor for bedre at forstå dens rolle i at afbøde kræftaktivitet i
Undersøgelse bruger neutroner til at skinne lys på lukning af kræftcellerSt. Jude-forsker Eric Gibbs klargør prøver til neutroneksperimenter for at studere forskellige sammensætninger af en proteintumorsuppressor for bedre at forstå dens rolle i at afbøde kræftaktivitet i -
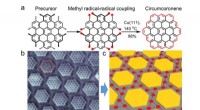 Syntese på overfladen af grafenmolekyler og deres supergitterFigur viser transformationen fra precursor-molekylet til det atomisk præcise circumcoronen-supergitter. (a) Precursormolekylet gennemgår en kemisk cyclodehydrogeneringsproces med brug af kobber (111)
Syntese på overfladen af grafenmolekyler og deres supergitterFigur viser transformationen fra precursor-molekylet til det atomisk præcise circumcoronen-supergitter. (a) Precursormolekylet gennemgår en kemisk cyclodehydrogeneringsproces med brug af kobber (111) -
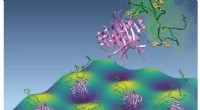 Skyerne af spaghetti, der holder DNA-data sikreForskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David
Skyerne af spaghetti, der holder DNA-data sikreForskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David
- Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur
- Ny ressource til lærere, offentlig om, hvordan man genkender videnskab, når man ser den
- Blanding i stjernedannende skyer forklarer, hvorfor søskendestjerner ligner hinanden
- SpaceX er klar til at lancere last fra den historiske NASA -pad
- Ældre jobansøgere er op til tre gange mindre tilbøjelige til at blive udvalgt til samtale end yng…
- Hvad kan eksistere som en fast væske og gas?


