Opløses brintoverilte i vand?
Opløsningen af hydrogenperoxid i vand er en fysisk proces, der involverer intermolekylære interaktioner mellem de polære molekyler af hydrogenperoxid og vandmolekyler. Hydrogenperoxid er et polært molekyle på grund af forskellen i elektronegativitet mellem oxygen- og brintatomer. Iltatomerne i hydrogenperoxid har en delvis negativ ladning (δ-), mens brintatomerne har en delvis positiv ladning (δ+).
Når hydrogenperoxid tilsættes vand, justerer de polære vandmolekyler og interagerer med de polære hydrogenperoxidmolekyler gennem dipol-dipol-interaktioner. Den delvise positive ladning af hydrogenatomer i hydrogenperoxid tiltrækkes af den delvise negative ladning af iltatomer i vand og omvendt. Disse intermolekylære interaktioner fører til opløsning af hydrogenperoxid i vand.
Opløsningen af hydrogenperoxid i vand påvirkes også af andre faktorer som temperatur og tryk. Generelt stiger opløseligheden af hydrogenperoxid med stigende temperatur og falder med stigende tryk. Ved højere temperaturer overvinder den øgede kinetiske energi af vandmolekyler de intermolekylære interaktioner mellem hydrogenperoxidmolekyler, hvilket fører til en højere grad af opløsning. På den anden side favoriserer højere tryk dannelsen af hydrogenperoxidklynger, hvilket resulterer i nedsat opløselighed.
Sidste artikelHvilken type binding er der i cadmiumsulfid?
Næste artikelHvordan kan du få ozon?
 Varme artikler
Varme artikler
-
 Luftstabile iboende strækbare farvekonverteringslag til strækbare skærmeKredit:CC0 Public Domain Udviklingen af et strækbart display, der kan bøjes, strakt, og knyttet til huden som en fritstående film optrådte i science fiction-film forventes at være et skridt nærm
Luftstabile iboende strækbare farvekonverteringslag til strækbare skærmeKredit:CC0 Public Domain Udviklingen af et strækbart display, der kan bøjes, strakt, og knyttet til huden som en fritstående film optrådte i science fiction-film forventes at være et skridt nærm -
 Hvor godt match er det? Lægger statistik ind i retsmedicinsk skydevåbenidentifikationWilmer Souder, en fysiker og tidlig retsmediciner ved National Bureau of Standards, nu NIST, sammenligner to kugler ved hjælp af et sammenligningsmikroskop. Souder lærte retsmedicinske teknikker af Ca
Hvor godt match er det? Lægger statistik ind i retsmedicinsk skydevåbenidentifikationWilmer Souder, en fysiker og tidlig retsmediciner ved National Bureau of Standards, nu NIST, sammenligner to kugler ved hjælp af et sammenligningsmikroskop. Souder lærte retsmedicinske teknikker af Ca -
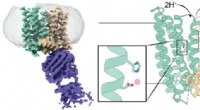 Afslører den uventede struktur af jern-eksportør ferroportin3D -struktur af et ferroportin fra pattedyr. Det venstre panel viser et kryo-EM-tæthedskort over ferroportin (blågrønt og brunt) i kompleks med et antistof (lilla). Midter- og højre panel viser en teg
Afslører den uventede struktur af jern-eksportør ferroportin3D -struktur af et ferroportin fra pattedyr. Det venstre panel viser et kryo-EM-tæthedskort over ferroportin (blågrønt og brunt) i kompleks med et antistof (lilla). Midter- og højre panel viser en teg -
 Ny undersøgelse bekræfter bølget arkproteinstruktur forudsagt i 1953Det krusede betaark er en variation af det plisserede betaark, et velkendt strukturelt motiv, der findes i tusindvis af proteiner. Linus Pauling og Robert Corey beskrev det krusede beta-ark i 1953, me
Ny undersøgelse bekræfter bølget arkproteinstruktur forudsagt i 1953Det krusede betaark er en variation af det plisserede betaark, et velkendt strukturelt motiv, der findes i tusindvis af proteiner. Linus Pauling og Robert Corey beskrev det krusede beta-ark i 1953, me
- Computer, er mit eksperiment afsluttet? Forskere diskuterer brugen af AI-agenter i deres forskning
- Faktorering i gravitomagnetisme kunne gøre op med mørkt stof
- Børn gik tilbage til skolen frygtede for COVID-19, forskningsfund
- Den første præcise måling af et enkelt molekyls effektive ladning
- Stempelmotorens historie
- Simuleringer afslører, hvordan saltvand opfører sig i Jordens kappe


