Hvilken hydroquinon er en organisk forbindelse, den har en molær masse på 110,1 gram over mol og sammensætning 65,45 procent C 5,45 H 29,09 O med masse. Den molekylære formel?
1. Bestem den empiriske formel:
* Antag en 100 g prøve: Dette gør procenterne direkte lig med gram.
* Konverter gram til mol:
* Kulstof:65,45 g / 12,01 g / mol =5,45 mol
* Hydrogen:5,45 g / 1,01 g / mol =5,40 mol
* Oxygen:29,09 g / 16,00 g / mol =1,82 mol
* divider med det mindste antal mol:
* Carbon:5,45 mol / 1,82 mol =3
* Hydrogen:5,40 mol / 1,82 mol =3
* Oxygen:1,82 mol / 1,82 mol =1
* Den empiriske formel er C3H3O
2. Bestem den molekylære formel:
* Beregn den empiriske formelmasse: (3 * 12,01) + (3 * 1,01) + (1 * 16,00) =55,06 g/mol
* Find forholdet mellem den molære masse og den empiriske formelmasse: 110,1 g/mol/55,06 g/mol =2
* Multiplicer underskrifterne i den empiriske formel med forholdet: C3H3O * 2 = C6H6O2
Derfor er den molekylære formel for hydroquinon C6H6O2.
 Varme artikler
Varme artikler
-
 Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven
Forskere laver ny opskrift på kringleformede peptiderDr. Christoph Nitsche. Kredit:Australian National University Forskere fra The Australian National University (ANU) har udviklet en ny måde at syntetisere bicykliske peptider på, med store konsekven -
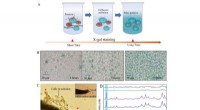 Ny SERS-strategi udviklet til beta-galactosidase aktivitetsanalyseIn-situ SERS udlæsningsstrategi for individuelle celler. (A) Skematisk strategi for at forbedre pålideligheden ved at forkorte farvningstider. (B) X-gal farvning assay for celler. (C og D) In-situ SER
Ny SERS-strategi udviklet til beta-galactosidase aktivitetsanalyseIn-situ SERS udlæsningsstrategi for individuelle celler. (A) Skematisk strategi for at forbedre pålideligheden ved at forkorte farvningstider. (B) X-gal farvning assay for celler. (C og D) In-situ SER -
 En ny måde at fremstille MXene-film på, der blokerer for elektromagnetisk interferensMed boomet i bærbar elektronik, Internet of Things-enheder og mere, belægninger, der blokerer for elektromagnetisk stråling, er ved at blive en kritisk del af fremstillingsprocessen. Andre ́ D. Taylor
En ny måde at fremstille MXene-film på, der blokerer for elektromagnetisk interferensMed boomet i bærbar elektronik, Internet of Things-enheder og mere, belægninger, der blokerer for elektromagnetisk stråling, er ved at blive en kritisk del af fremstillingsprocessen. Andre ́ D. Taylor -
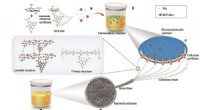 Forskere bruger mikroorganismer til at fremstille funktionel bakteriel cellulose in situGlucose (Glc) blev modificeret med 6CF, og 6CF-Glc blev brugt som en kulstofkilde til K. sucrofermentans fermentering for at opnå 6CF-BC gennem mikrobielle metaboliske veje Kredit:GAO Minghong Bak
Forskere bruger mikroorganismer til at fremstille funktionel bakteriel cellulose in situGlucose (Glc) blev modificeret med 6CF, og 6CF-Glc blev brugt som en kulstofkilde til K. sucrofermentans fermentering for at opnå 6CF-BC gennem mikrobielle metaboliske veje Kredit:GAO Minghong Bak
- At leve med luftforurening
- VRTIGO lader dig teste dine nerver i virtual reality
- Hvad hedder teorien, der forklarer forskellige stater, i hvilken sag kan eksistere?
- Jordmorm Phylum Egenskaber
- Hvorfor klormolekyler nedbrydes for at give Cl frie radikaler, forklar venligst i form af kc?
- Ny teknik brugt til at opdage, hvordan galakser vokser


