Hvad er den molære masse af en ukendt gas i en 1,8L -beholder, hvis 589 g har tryk. .090atm ved 20c?
1. Konverter temperatur til Kelvin
* T (kelvin) =t (celsius) + 273.15
* T =20 ° C + 273,15 =293,15 K
2. Brug den ideelle gaslov
* PV =NRT
* P =tryk (atm) =0,090 atm
* V =volumen (L) =1,8 L
* n =mol gas (mol)
* R =ideel gas konstant =0,0821 l · atm/mol · k
* T =temperatur (k) =293,15 k
3. Løs for mol (n)
* n =(PV) / (RT)
* n =(0,090 atm * 1,8 L) / (0,0821 L · ATM / Mol · K * 293,15 K)
* n ≈ 0,067 mol
4. Beregn molmasse
* Molmasse =masse (g) / mol (mol)
* Molmasse =589 g / 0,067 mol
* Molmasse ≈ 8800 g/mol
Derfor er den molære masse af den ukendte gas ca. 8800 g/mol.
Vigtig note: Denne beregning antager, at gassen opfører sig ideelt. I virkeligheden kan gasser afvige fra ideel opførsel ved høje tryk eller lave temperaturer.
Sidste artikelEr kogepunktet brint eller ilt koldere?
Næste artikelHvis du lægger eddike på kalksten, slynger det sig?
 Varme artikler
Varme artikler
-
 Overstrømning:Hemmelighederne ved denne stinkende svenske fiskKredit:The American Chemical Society Det er blevet kaldt den lugtende mad i verden. Men surströmming - svensk for sur sild - er elsket i Sverige som en sommerglæde. I denne video, Reactions for
Overstrømning:Hemmelighederne ved denne stinkende svenske fiskKredit:The American Chemical Society Det er blevet kaldt den lugtende mad i verden. Men surströmming - svensk for sur sild - er elsket i Sverige som en sommerglæde. I denne video, Reactions for -
 C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli
C. elegans rundorme høster et vigtigt coenzym fra de bakterier, de indtagerCaenorhabditis elegans. Kredit:Wikipedia En undersøgelse udført i C. elegans nematode rundorm kan føre til forbedret behandling af en sjælden menneskelig genetisk lidelse, der forårsager alvorli -
 Kan dette invasive eksotiske skadedyr lave bedre materialer til industri og medicin?Selvom det var uappetitligt i dette lab -skud, disse skabninger bruges allerede til mange andre formål, herunder som ingrediens i det asiatiske køkken. Kredit:Johan Foster Forskere ved National In
Kan dette invasive eksotiske skadedyr lave bedre materialer til industri og medicin?Selvom det var uappetitligt i dette lab -skud, disse skabninger bruges allerede til mange andre formål, herunder som ingrediens i det asiatiske køkken. Kredit:Johan Foster Forskere ved National In -
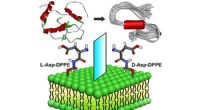 Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af
Nye fund kaster lys over udviklingen af liposom-baserede hæmmereMolekylær chiralitet medieret amyloiddannelse på phospholipidoverflader. Kredit:WANG Xue Alzheimers sygdom (AD) er en af de største globale folkesundhedsudfordringer. Imidlertid, patogenesen af
- Hvordan laver PH papir?
- Pop-up-effekten:Hvorfor flydende kugler ikke altid springer ud af vandet
- Hvilket biogeokemisk kredsløb er mindst afhængig af biotiske processer?
- Hvordan Body Farms fungerer
- USA's klimabeslutning gør Europa forarget, forfærdet
- Hvor mange mol af en ideel gas vil besætte en bind 20 liter ved 3,5 atm og 280k?


