Hvad er CH- og OH -obligationer?
C-H-obligationer
* hvad de er: En C-H-binding er en kovalent binding mellem et carbonatom (C) og et hydrogenatom (H).
* hvordan de danner: Carbon har fire valenselektroner, hvilket betyder, at det kan danne fire bindinger. Hydrogen har en valenselektron og kan danne en binding. Delingen af disse elektroner skaber en stabil kovalent binding.
* styrke: C-H-bindinger er relativt stærke, hvilket gør dem almindelige i organiske molekyler (molekyler indeholdende kulstof).
* fundet i:
* kulbrinter: Molekyler sammensat kun af kulstof og brint (som metan, propan og benzin)
* Mange organiske molekyler: Inklusive alkoholer, aldehyder, ketoner og endda komplekse biomolekyler som proteiner og kulhydrater.
O-H-obligationer
* hvad de er: En O-H-binding er en kovalent binding mellem et iltatom (O) og et hydrogenatom (H).
* hvordan de danner: Oxygen har seks valenselektroner og kan danne to bindinger. Hydrogen har en valenselektron og kan danne en binding. Delingen af disse elektroner skaber en stabil kovalent binding.
* styrke: O-H-bindinger er stærkere end C-H-bindinger og er kendt for deres polaritet.
* Polaritet: Oxygen er mere elektronegativ end brint, hvilket betyder, at det tiltrækker de delte elektroner stærkere. Dette skaber en delvis negativ ladning på ilt og en delvis positiv ladning på brint, hvilket gør bindingen polær.
* fundet i:
* vand (H₂O): Det mest almindelige eksempel.
* Alkoholer: Molekyler indeholdende en -OH -gruppe (som ethanol).
* carboxylsyrer: Molekyler indeholdende en -cooh -gruppe (som eddikesyre).
* Mange andre funktionelle grupper: Disse obligationer er vigtige for at skabe de unikke egenskaber hos disse grupper.
Nøgle takeaways:
* Både C-H og O-H-bindinger er vigtige i organisk kemi.
* C-H-bindinger er relativt stærke og findes i mange organiske molekyler.
* O-H-bindinger er polære og spiller en afgørende rolle i egenskaberne ved mange molekyler, især vand.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelHvad sker der, når væsken afkøles?
Næste artikelHvordan renser du grønt fra metal?
 Varme artikler
Varme artikler
-
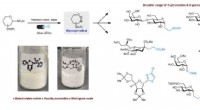 Aktivering af synligt lys muliggør transformation af bordstabile sulfoner til værdifulde glykoside…Skematisk, der viser designet af et synligt lys-medieret system til at krydskoble forskellige elektrofiler med glycosylradikaler afledt af bench-stabile heteroarylsulfoner. Kredit:Nature Synthesis (20
Aktivering af synligt lys muliggør transformation af bordstabile sulfoner til værdifulde glykoside…Skematisk, der viser designet af et synligt lys-medieret system til at krydskoble forskellige elektrofiler med glycosylradikaler afledt af bench-stabile heteroarylsulfoner. Kredit:Nature Synthesis (20 -
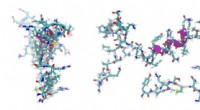 Mekanokemisk peptidbindingsdannelse bag livets oprindelseKredit:CC0 Public Domain Tilstedeværelsen af aminosyrer på den præbiotiske jord er bredt accepteret, enten kommer fra endogene kemiske processer eller leveres af udenjordisk materiale. På den an
Mekanokemisk peptidbindingsdannelse bag livets oprindelseKredit:CC0 Public Domain Tilstedeværelsen af aminosyrer på den præbiotiske jord er bredt accepteret, enten kommer fra endogene kemiske processer eller leveres af udenjordisk materiale. På den an -
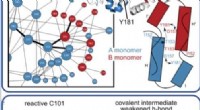 Forskere afslører, hvordan enzymbevægelser katalyserer reaktionerDenne illustration viser, hvordan et enzym bevæger sig og ændrer sig, når det katalyserer komplekse reaktioner og nedbryder organiske forbindelser. Kredit: Proceedings of the National Academy of Scien
Forskere afslører, hvordan enzymbevægelser katalyserer reaktionerDenne illustration viser, hvordan et enzym bevæger sig og ændrer sig, når det katalyserer komplekse reaktioner og nedbryder organiske forbindelser. Kredit: Proceedings of the National Academy of Scien -
 Produktionsteknologi for nye flystrukturer har øget deres styrke3D-printede kompositdele. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra NUST MISIS har udviklet en metode til fremstilling af kompositdele til luftfartsindustrien, som har øget styrken af færdige
Produktionsteknologi for nye flystrukturer har øget deres styrke3D-printede kompositdele. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra NUST MISIS har udviklet en metode til fremstilling af kompositdele til luftfartsindustrien, som har øget styrken af færdige
- Risiciene aftager for Colorado River-reservoirer efter våd vinter, men langsigtede udfordringer tru…
- DNA slår et århundredegammelt mysterium om New Zealands kun uddøde ferskvandsfisk
- Hvad er oxidationstallet for ZnHSO32?
- Hvordan er intensiteten af lydmåling?
- Hvad sker der, hvis du lægger alger i nærheden af sollys?
- Nordeksponerede isklipper fremskynder gletsjersmeltningen


