Hvordan er de empriske og molekylære formulære for en sammensat relateret?
* Empirisk formel: Repræsenterer det enkleste forhold mellem hele antal atomer i en forbindelse. Det fortæller dig den type atomer, der er til stede og deres relative proportioner.
* molekylær formel: Repræsenterer det faktiske antal atomer i hvert element i et molekyle af forbindelsen.
Her er nøgleforholdet:
* Molekylformlen er altid et multiplum af hele nummeret af den empiriske formel.
Eksempel:
* glukose:
* Empirisk formel: CH₂O (dette er det enkleste forhold mellem kulstof-, brint- og iltatomer)
* molekylær formel: C₆h₁₂o₆ (dette er det faktiske antal atomer i et glukosemolekyle)
For at komme fra empirisk formel til molekylær formel, har du brug for:
1. den empiriske formel: Dette fortæller dig de grundlæggende atomforhold.
2. Den molære masse af forbindelsen: Dette fortæller dig den faktiske masse af et molekyle.
Sådan finder du molekylformlen:
1. Beregn den empiriske formelmasse: Tilsæt atommasserne af atomerne i den empiriske formel.
2. Opdel den molære masse af forbindelsen med den empiriske formelmasse: Dette giver dig hele nummermultiplikatoren til den empiriske formel.
3. Multiplicer underskrifterne i den empiriske formel med multiplikatoren: Dette giver dig den molekylære formel.
Kortfattet:
* Den empiriske formel fortæller dig * type * og * relativt antal * atomer i en forbindelse.
* Den molekylære formel fortæller dig det * faktiske antal * atomer i et molekyle af forbindelsen.
* Den molekylære formel er altid et multiplum med hele nummer af den empiriske formel.
 Varme artikler
Varme artikler
-
 Forskere designer organisk katode til højtydende batterierHovedforfatter Zulipiya Shadike (til højre) er afbilledet ved NSLS-IIs XPD-strålelinje sammen med videnskabsmand og medforfatter Sanjit Ghose (til venstre). Kredit:Brookhaven National Laboratory F
Forskere designer organisk katode til højtydende batterierHovedforfatter Zulipiya Shadike (til højre) er afbilledet ved NSLS-IIs XPD-strålelinje sammen med videnskabsmand og medforfatter Sanjit Ghose (til venstre). Kredit:Brookhaven National Laboratory F -
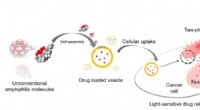 Ny teknologi til levering af kræft mod kræftOversigt over forsøget. Hule græskarformede molekyler med allyloxyhaler samler sig selv i vesikler, som kan transportere lægemidler ind i kræftceller. Derefter bryder en laser vesiklerne, hvilket lett
Ny teknologi til levering af kræft mod kræftOversigt over forsøget. Hule græskarformede molekyler med allyloxyhaler samler sig selv i vesikler, som kan transportere lægemidler ind i kræftceller. Derefter bryder en laser vesiklerne, hvilket lett -
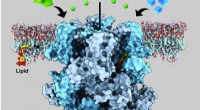 Form af struktur, som nerveceller bruger til at fornemme kulde og menthol, kunne være et nyt mål f…En ionkanal i humane nerveceller kaldet det forbigående receptorpotentielle melastatinelement 8 (TRPM8) registrerer både kulde og menthol, overføre kølende fornemmelser ved at frigive calcium (grønne
Form af struktur, som nerveceller bruger til at fornemme kulde og menthol, kunne være et nyt mål f…En ionkanal i humane nerveceller kaldet det forbigående receptorpotentielle melastatinelement 8 (TRPM8) registrerer både kulde og menthol, overføre kølende fornemmelser ved at frigive calcium (grønne -
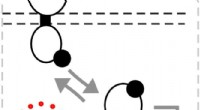 Teknik til at finjustere to-komponent biologiske sensorerKredit:Rice University Rice University-forskere, der siger, at biologiske sensorer ikke er følsomme nok, gør noget ved det. Laboratoriet af syntetisk biolog Jeffrey Tabor har introduceret en ny t
Teknik til at finjustere to-komponent biologiske sensorerKredit:Rice University Rice University-forskere, der siger, at biologiske sensorer ikke er følsomme nok, gør noget ved det. Laboratoriet af syntetisk biolog Jeffrey Tabor har introduceret en ny t
- Hvilken ændring vil der ske, når kobbersulfat opvarmes?
- Eleverne opdager skjult tekst fra det 15. århundrede på middelalderlige manuskripter
- Hvilken type jord er til stede i Guano?
- Forskere afslører biogeokemiske kontroller af forekomst og fordeling af PAC'er i kul
- Hvor meget ilt indånder du på en dag, og hvordan energi giver det os?
- Hvilke organer eller dele af planten er involveret i transpiration?


