Hvad er forholdet mellem gastemperatur og volumen?
Ved konstant tryk er volumenet af en given masse af en ideel gas direkte proportional med dens absolutte temperatur.
Dette betyder, at hvis du øger temperaturen på en gas, mens du holder trykket konstant, vil volumenet også stige proportionalt.
her er en simpel forklaring:
* Temperatur er et mål for den gennemsnitlige kinetiske energi for gasmolekylerne.
* volumen er pladsen besat af gasmolekylerne.
* Når temperaturen stiger, bevæger molekylerne sig hurtigere og kolliderer hyppigere med containervæggene.
* Dette øgede kollisionstryk skubber beholdervæggene udad, hvilket resulterer i en stigning i volumen.
Matematisk kan Charles lov udtrykkes som:
V₁/t₁ =v₂/t₂
Hvor:
* V₁ =indledende bind
* T₁ =indledende absolut temperatur (i Kelvin)
* V₂ =slutvolumen
* T₂ =endelig absolut temperatur (i Kelvin)
Vigtig note:
* Charles 'lov gælder for ideelle gasser, som er teoretiske gasser, der opfører sig perfekt i henhold til gaslovene.
* Ægte gasser afviger fra ideel opførsel ved højt tryk og lave temperaturer.
* For at bruge Charles lov skal du udtrykke temperaturen i Kelvin, ikke Celsius.
Eksempel:
Hvis en ballon med et volumen på 1 liter ved 20 ° C (293 K) opvarmes til 40 ° C (313 K), vil dens volumen stige til:
V₂ =V₁ * T₂ / T₁
V₂ =1 L * 313 K / 293 K
V₂ ≈ 1,07 L
Volumenet stiger med ca. 7%, når temperaturen stiger med 20 ° C.
Sidste artikelHvilken gren af kemi involverer kulstofbaserede molekyler?
Næste artikelMol gasser ved standardtemperaturtryk?
 Varme artikler
Varme artikler
-
 Forskere udvikler måde at bruge affaldsplastik til at skabe bilbrændstofDr. Moritz Kuehnel, fra Swansea University, som er en del af teamet, der udvikler en proces til at omdanne uønsket plastik til brint, som igen kan bruges til at køre biler. Kredit:Swansea University
Forskere udvikler måde at bruge affaldsplastik til at skabe bilbrændstofDr. Moritz Kuehnel, fra Swansea University, som er en del af teamet, der udvikler en proces til at omdanne uønsket plastik til brint, som igen kan bruges til at køre biler. Kredit:Swansea University -
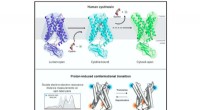 Undersøgelse afslører den molekylære oprindelse af den genetiske sygdom cystinoseStrukturelle og biofysiske undersøgelser af humant cystinosin afslører molekylære mekanismer og konformationel dynamik i protonkoblet lysosomal aminosyretransport. Kredit:Guo et al., Cell 2022 Den
Undersøgelse afslører den molekylære oprindelse af den genetiske sygdom cystinoseStrukturelle og biofysiske undersøgelser af humant cystinosin afslører molekylære mekanismer og konformationel dynamik i protonkoblet lysosomal aminosyretransport. Kredit:Guo et al., Cell 2022 Den -
 Membranløse protoceller kunne give spor til dannelsen af tidligt livMembranløse protoceller - kaldet komplekse koacervater - kan samle RNA-molekyler, hvilket gør det muligt for RNAerne at udføre visse reaktioner, et vigtigt skridt i livets oprindelse på Jorden. Billed
Membranløse protoceller kunne give spor til dannelsen af tidligt livMembranløse protoceller - kaldet komplekse koacervater - kan samle RNA-molekyler, hvilket gør det muligt for RNAerne at udføre visse reaktioner, et vigtigt skridt i livets oprindelse på Jorden. Billed -
 Ved at kopiere bakterielle enzymer, laboratoriet lærer hurtigt at syntetisere ny klasse af antibiot…Jordbakterien Pseudomonas fluorescens, her lyser stærkt under ultraviolet lys, udstråler et antibiotikum kaldet obafluorin, der har en ny ß-lactonstruktur. Kredit:Washington University i St. Louis
Ved at kopiere bakterielle enzymer, laboratoriet lærer hurtigt at syntetisere ny klasse af antibiot…Jordbakterien Pseudomonas fluorescens, her lyser stærkt under ultraviolet lys, udstråler et antibiotikum kaldet obafluorin, der har en ny ß-lactonstruktur. Kredit:Washington University i St. Louis
- Hvad er det modsatte af det ydre rum?
- Hvordan påvirker en form dens biologiske funktion?
- Den langsomme dannelse af ler og tynde jord i ørkenen skyldes?
- Nyt venture teams succes kræver kollektivt ejerskab – med grænser, siger undersøgelse
- Hvilken klasse af forbindelser hører stivelse og sukker?
- omrørt, ikke rystet:Magnetiske rørestave i nanoskala


