Hvorfor er metaller bedre ledere end keramik?
Metaller:
* Gratis elektroner: Metaller har et "hav" af delokaliserede elektroner, der ikke er tæt bundet til noget bestemt atom. Disse elektroner er frit at bevæge sig gennem materialet, hvilket muliggør let transport af elektrisk ladning.
* Metallisk binding: Atomerne i metaller holdes sammen af et "hav" af delokaliserede elektroner, som bidrager til deres høje ledningsevne.
* Høj elektronmobilitet: De frie elektroner i metaller kan bevæge sig hurtigt og let som svar på et elektrisk felt, hvilket gør dem til fremragende ledere af elektricitet og varme.
keramik:
* kovalent binding: Keramik holdes typisk sammen af stærke kovalente bindinger, hvor elektroner deles mellem atomer. Disse bindinger er lokaliserede, hvilket betyder, at elektronerne ikke er frie til at bevæge sig let.
* ionisk binding: Nogle keramik har også ioniske bindinger, hvor elektroner overføres mellem atomer, hvilket skaber ladede ioner. Dette kan yderligere begrænse elektronmobilitet.
* Begrænset elektronmobilitet: Den stærke og lokaliserede binding i keramik begrænser bevægelsen af elektroner, hvilket fører til dårlig ledningsevne.
Kortfattet:
Metaller har fri bevægende elektroner på grund af deres bindingsstruktur, hvilket gør dem til fremragende ledere. Keramik har med deres stærke og lokaliserede binding begrænset elektronmobilitet, hvilket resulterer i dårlig ledningsevne.
 Varme artikler
Varme artikler
-
 Sådan binder du bomuld med agern og rustTie-dyeing bomuldsstof med agern og rustløsninger gør det brunt, orange, blåt og sort. Kredit:Tilpasset fra Journal of Chemical Education 2022, DOI:10.1021/acs.jchemed.2c00086 Tie-dyeing er en sjov
Sådan binder du bomuld med agern og rustTie-dyeing bomuldsstof med agern og rustløsninger gør det brunt, orange, blåt og sort. Kredit:Tilpasset fra Journal of Chemical Education 2022, DOI:10.1021/acs.jchemed.2c00086 Tie-dyeing er en sjov -
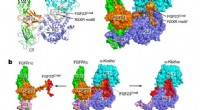 Forskere opdager strukturen af anti-aging hormonOverordnet topologi af FGF23-FGFR1cecto-α-klothoecto-komplekset. en, Tegneserie (venstre) og overfladerepræsentation (højre) af den ternære komplekse struktur. α-klotho KL1 (cyan) og KL2 (blå) domæner
Forskere opdager strukturen af anti-aging hormonOverordnet topologi af FGF23-FGFR1cecto-α-klothoecto-komplekset. en, Tegneserie (venstre) og overfladerepræsentation (højre) af den ternære komplekse struktur. α-klotho KL1 (cyan) og KL2 (blå) domæner -
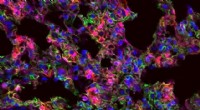 Nye materialer forbedrer leveringen af terapeutisk messenger-RNAMIT-forskere har designet nanopartikler, der kan levere messenger-RNA til specifikke organer. På dette billede, lungeceller, der udtrykker det syntetiske mRNA, viser sig som røde. Kredit:Piotr Kowalsk
Nye materialer forbedrer leveringen af terapeutisk messenger-RNAMIT-forskere har designet nanopartikler, der kan levere messenger-RNA til specifikke organer. På dette billede, lungeceller, der udtrykker det syntetiske mRNA, viser sig som røde. Kredit:Piotr Kowalsk -
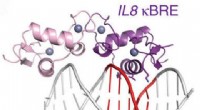 Duel af de inflammatoriske masterregulatorer – indsigt til lægemiddelopdagelseFigur:Diagram over glukokortikoidreceptoren, der binder et NF-kappaB-sted. Kredit:Hudson et al. Naturkommunikation (2018). Anti-inflammatoriske lægemidler såsom dexamethason kan have skadelige biv
Duel af de inflammatoriske masterregulatorer – indsigt til lægemiddelopdagelseFigur:Diagram over glukokortikoidreceptoren, der binder et NF-kappaB-sted. Kredit:Hudson et al. Naturkommunikation (2018). Anti-inflammatoriske lægemidler såsom dexamethason kan have skadelige biv


