Hvad sker der, når natrium reagerer med saltsyre?
Her er den afbalancerede kemiske ligning:
2 Na + 2 HCl → 2 NaCl + H₂
Her er en sammenbrud af, hvad der sker:
* natrium (NA) er et meget reaktivt alkalimetal.
* saltsyre (HCL) er en stærk syre.
* brintgas (H₂) er en farveløs, lugtfri gas.
* natriumchlorid (NaCl) er et hvidt krystallinsk fast stof.
Reaktionen er eksoterm , hvilket betyder, at den frigiver varme og kan være ret voldelig, især med større natriumstykker. Reaktionen producerer en masse varme, som kan antænde den producerede brintgas. Reaktionen er også meget hurtig, hvilket gør det vanskeligt at kontrollere.
Her er en beskrivelse af, hvad du måtte observere:
* Natriummetalen reagerer kraftigt med syren og producerer bobler af brintgas.
* Løsningen opvarmes hurtigt.
* Der kan være en lys flash af lys og en høj poppinglyd, når brintgassen antændes.
* Opløsningen bliver overskyet som natriumchloridformer.
sikkerhed:
* Denne reaktion er ekstremt farlig og bør kun udføres af uddannede fagfolk i en kontrolleret laboratorieindstilling.
* Forsøg aldrig denne reaktion derhjemme.
* Brug altid passende sikkerhedsudstyr, inklusive beskyttelsesbriller og handsker.
Ansøgninger:
Denne reaktion bruges ikke i hverdagen, men bruges i laboratorieindstillinger til:
* Undersøgelse af metallers reaktivitet.
* Demonstration af egenskaber ved syrer.
* Generering af brintgas.
Sidste artikelHvordan adskiller sig hydrogengas og gas?
Næste artikelHvor mange brintbindinger kan alkoholform?
 Varme artikler
Varme artikler
-
 Hvis bare A.I. havde en hjerne - ingeniører modellerer en kunstig synapse efter den menneskelige hj…Pitt-ingeniører byggede en grafen-baseret kunstig synapse i en todimensionel, bikage -konfiguration af kulstofatomer, der viste fremragende energieffektivitet, der kan sammenlignes med biologiske syna
Hvis bare A.I. havde en hjerne - ingeniører modellerer en kunstig synapse efter den menneskelige hj…Pitt-ingeniører byggede en grafen-baseret kunstig synapse i en todimensionel, bikage -konfiguration af kulstofatomer, der viste fremragende energieffektivitet, der kan sammenlignes med biologiske syna -
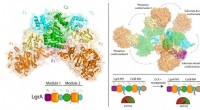 Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af
Ny forståelse af antibiotikasynteseKredit:McGill University Forskere ved McGill Universitys medicinske fakultet har gjort vigtige fremskridt med at forstå funktionen af enzymer, der spiller en integreret rolle i produktionen af -
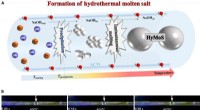 Et nyt opløsningsmiddelsystem:Hydrotermalt smeltet saltDannelse af HyMoS. (A) Skema for dannelsen af HyMoS i SCW, med eksemplet på NaOH. (B) Montagebillede fra film S1 (nedenfor), der viser den direkte observation og bevægelse af en smeltet NaOH -dråbe
Et nyt opløsningsmiddelsystem:Hydrotermalt smeltet saltDannelse af HyMoS. (A) Skema for dannelsen af HyMoS i SCW, med eksemplet på NaOH. (B) Montagebillede fra film S1 (nedenfor), der viser den direkte observation og bevægelse af en smeltet NaOH -dråbe -
 Ny forskning identificerer Fukushima -reaktormateriale i miljøetEt 3D-billede, der tillod forskerne at opdage fordelingen af elementer i prøven. Kredit:University of Bristol/Diamond Light Source Gennem analyse af specifikke nedfaldspartikler i miljøet, et fæ
Ny forskning identificerer Fukushima -reaktormateriale i miljøetEt 3D-billede, der tillod forskerne at opdage fordelingen af elementer i prøven. Kredit:University of Bristol/Diamond Light Source Gennem analyse af specifikke nedfaldspartikler i miljøet, et fæ
- NASAs Aqua Satellite ser den tropiske cyklon Veronica udvikle sig ud for den vestlige australske kys…
- Kvinder er meget mindre tilbøjelige til at stille spørgsmål på akademiske seminarer end mænd
- Smog kvæler kulafhængigt Polen
- Stoffer der påvirker smeltefrekvensen Ice
- Mendeleev kombinerede ideerne fra to tidligere videnskabsmænd, som var disse, og hvad gjorde de?
- Fysikere finder beviser for tidligere usete overgange i ferroelektrik


