Beskriv bindingen i en krystal af jod?
limning i iodkrystall:
Jodkrystaller Udstilling A ikke -polær kovalent binding Inden for hvert jodmolekyle (i 2 ) og van der Waals Forces mellem disse molekyler. Lad os nedbryde det:
1. Kovalent binding inden for i 2 :
* Jodatomer deler elektroner til at danne en enkelt kovalent binding, der afslutter deres oktet.
* Denne obligation er ikke -polær Fordi begge jodatomer har den samme elektronegativitet, hvilket resulterer i en lige deling af elektroner.
2. Van der Waals kræfter mellem i 2 Molekyler:
* I 2 Molekyler selv holdes sammen af London Dispersion Forces , en type van der Waals Force.
* Disse kræfter stammer fra midlertidige udsving i elektronfordeling inden for molekylerne, hvilket skaber midlertidige dipoler.
* Disse inducerede dipoler tiltrækker hinanden og skaber en svag intermolekylær kraft.
Det samlede bindingsbillede:
* Hvert iodatom danner en stærk kovalent binding med et andet jodatom til dannelse af et i 2 molekyle.
* Disse molekyler holdes derefter svagt sammen af London -spredningskræfter og danner en krystallinsk struktur.
Nøgleegenskaber ved iodkrystaller på grund af binding:
* fast ved stuetemperatur: På grund af de relativt stærke van der Waals -styrker eksisterer jod som et fast stof.
* sublimerbar: De svage intermolekylære kræfter tillader jod let at skifte fra fast til gas og udvise sublimering.
* Dårlig leder af varme og elektricitet: De kovalente obligationer inden for i 2 Molekyler er stærke, men de svage intermolekylære kræfter resulterer i dårlig ledningsevne.
* skinnende, mørkegrå farve: Dette er en konsekvens af molekylets evne til at absorbere synligt lys med undtagelse af violet lys, hvilket afspejles.
Sammenfattende er bindingen i jodkrystaller en kombination af stærke kovalente bindinger inden for hvert jodmolekyle og svage van der Waals -kræfter mellem dem. Dette samspil mellem kræfter giver jod sine karakteristiske fysiske egenskaber.
Sidste artikelHvor mange natriumioner i 6,2 gram Na2O?
Næste artikelHvad er alle de nyttige forbindelser?
 Varme artikler
Varme artikler
-
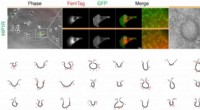 Ny metode opdaget til at se proteiner inde i menneskelige cellerFerriTagging af et protein kaldet HIP1R i clathrin-coatede gruber. Mærkning af HIP1R kan spores ved lysmikroskopi og elektronmikroskopi. Placeringen af Ferritin er vist med røde prikker i pit. Kredi
Ny metode opdaget til at se proteiner inde i menneskelige cellerFerriTagging af et protein kaldet HIP1R i clathrin-coatede gruber. Mærkning af HIP1R kan spores ved lysmikroskopi og elektronmikroskopi. Placeringen af Ferritin er vist med røde prikker i pit. Kredi -
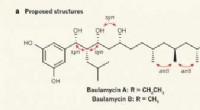 Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle
Kemikere udleder den korrekte struktur af A- og B-baulamycinerneTidligere foreslåede og faktiske molekylære strukturer af baulamycinerne. Kredit: Natur (2017). doi:10.1038/nature23265 (Phys.org) – Et team af kemikere ved University of Bristol har korrekt udle -
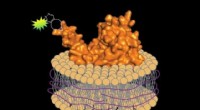 En platform til at forberede fluorescensmærkede proteiner og simulere deres native miljøVed at bruge en vaskemiddelfri metode, biologer kan fremstille fluorescens-mærkede proteiner sammen med et lille segment af den associerede cellemembran, bevare proteinets native miljø. Kredit:Jean-Ma
En platform til at forberede fluorescensmærkede proteiner og simulere deres native miljøVed at bruge en vaskemiddelfri metode, biologer kan fremstille fluorescens-mærkede proteiner sammen med et lille segment af den associerede cellemembran, bevare proteinets native miljø. Kredit:Jean-Ma -
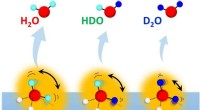 Indvirkningen af molekylær rotation på en ejendommelig isotopeffekt på vandhydrogenbindingerDesorption af vandisotopomerer (H 2 Åh, HDO og D 2 O) fra overflader af isotopblandet is med forskellige H/D-sammensætninger. Kredit:NINS/IMS Kvantenaturen af brintbindinger i vand manifeste
Indvirkningen af molekylær rotation på en ejendommelig isotopeffekt på vandhydrogenbindingerDesorption af vandisotopomerer (H 2 Åh, HDO og D 2 O) fra overflader af isotopblandet is med forskellige H/D-sammensætninger. Kredit:NINS/IMS Kvantenaturen af brintbindinger i vand manifeste
- Hvorfor er massen af atomerelektroner ikke inkluderet i antal?
- Latinas var mere tilbøjelige end andre grupper til at droppe ud af arbejdsstyrken under pandemi
- Ekspert sammenligner ufrivilligt samtykke fra vigtige arbejdere med udnyttelse af kvinder i voksenfi…
- Hvorfor stoppe ved plastikposer og sugerør? Sagen for en global traktat, der forbyder det meste eng…
- Sådan sporer manens vej over himlen
- Enzym har vist sig at kontrollere dannelsen af kollagenbærere og hæmme kollagensekretion


