Hvad er den empiriske formel for en forbindelse, der har efter sammensætning 39,81 procent kobber 20,06 svovl og resterende ilt. Kunne dette også være molekylær formel?
1. Antag en 100 g prøve
* Dette gør procenterne direkte til gram:
* 39,81 g Cu
* 20,06 g s
* (100 - 39,81 - 20,06) =40,13 g o
2. Konverter gram til mol
* Opdel hvert elements masse med dets molære masse:
* CU:39,81 g / 63,55 g / mol =0,627 mol
* S:20,06 g / 32,06 g / mol =0,626 mol
* O:40,13 g / 16,00 g / mol =2,51 mol
3. Find det enkleste molforhold
* Opdel hver molværdi med den mindste molværdi (0,626 mol):
* CU:0,627 mol / 0,626 mol ≈ 1
* S:0,626 mol / 0,626 mol ≈ 1
* O:2,51 mol / 0,626 mol ≈ 4
4. Empirisk formel
* Den empiriske formel repræsenterer det enkleste forhold mellem hele antal atomer i forbindelsen. Derfor er den empiriske formel cuso₄ .
Kan dette være den molekylære formel?
* Det er muligt, at den empiriske formel også er den molekylære formel. Vi har dog brug for mere information for at bekræfte dette. For at bestemme den molekylære formel har vi brug for den molære masse af forbindelsen.
Her er hvorfor:
* Den empiriske formel fortæller os kun det enkleste forhold mellem atomer.
* Den molekylære formel repræsenterer det faktiske antal atomer i et molekyle.
Eksempel:
* Hvis forbindelsens molære masse er 159,61 g/mol, er molekylformlen den samme som den empiriske formel (cuso₄), fordi den molære masse af cuso₄ er 159,61 g/mol.
* Men hvis den molære masse af forbindelsen er 319,22 g/mol, ville molekylformlen være cu₂s₂o₈ (to gange den empiriske formel).
Sidste artikelHvor mange atomer er der i 2,4 mol brint?
Næste artikelHvad er mineralgruppen af antimon?
 Varme artikler
Varme artikler
-
 En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn
En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn -
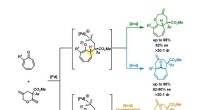 Divergent syntese af bicykliske mellemstore ringstrukturerFigur viser reaktionsvejene for den divergerende syntese af tre klasser af forbindelser. Ved at bruge det samme sæt af udgangsmaterialer og palladiumkatalysator, men udsat for forskellige reaktionsbet
Divergent syntese af bicykliske mellemstore ringstrukturerFigur viser reaktionsvejene for den divergerende syntese af tre klasser af forbindelser. Ved at bruge det samme sæt af udgangsmaterialer og palladiumkatalysator, men udsat for forskellige reaktionsbet -
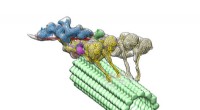 Mikroskopiske vogne leverer molekyler i vores cellerDynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle G
Mikroskopiske vogne leverer molekyler i vores cellerDynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle G -
 Ny katalysator producerer effektivt brint fra havvandZhifeng Ren, direktør for Texas Center for Superconductivity ved UH og M.D. Anderson Chair Professor i fysik, sagde den nye katalysator giver forskere mulighed for at undgå mange af de forhindringer,
Ny katalysator producerer effektivt brint fra havvandZhifeng Ren, direktør for Texas Center for Superconductivity ved UH og M.D. Anderson Chair Professor i fysik, sagde den nye katalysator giver forskere mulighed for at undgå mange af de forhindringer,
- Ny analyse af Chicxulub-asteroiden tyder på, at den kan have ramt et sårbart sted
- Sådan beregnes området med en buet overflade
- Hvad er et generelt navn for de forskellige stoffer eller materialer, gennem hvilke bølge bevæger …
- Ikke et praktisk eksempel på tyngdekraft, der handler på bevægende objekt?
- Forskere tager skridt til at forhindre seksuel chikane og skævhed
- Ny forskning viser beskyttende værdi af mangrover for kystlinjer


