Hvad er ligningen for aluminium plus saltsyre?
2al (s) + 6HCl (aq) → 2Alcl₃ (aq) + 3H₂ (g)
Her er en sammenbrud af reaktionen:
* 2al (r): Dette repræsenterer to mol fast aluminium.
* 6HCI (aq): Dette repræsenterer seks mol saltsyre i en vandig opløsning.
* 2Alcl₃ (aq): Dette repræsenterer to mol aluminiumchlorid, der opløses i opløsningen.
* 3H₂ (g): Dette repræsenterer tre mol brintgas, der frigives som bobler.
Forklaring:
Denne reaktion er en enkelt forskydningsreaktion, hvor aluminium (AL) er mere reaktiv end brint (H). Aluminiumet fortrænger brintet fra saltsyre og danner aluminiumchlorid (ALCL₃) og frigiver brintgas (H₂).
Denne reaktion er også eksoterm, hvilket betyder, at den frigiver varme og kan observeres ved udviklingen af varme og dannelsen af bobler.
 Varme artikler
Varme artikler
-
 Fingeraftryk mangler videnskabeligt grundlag for retssikkerhedKredit:Carnegie Mellon University Det kan overraske mange, især dem, der er modtagelige for CSI-effekten, men fingeraftryksbeviser er ikke afgørende ud over enhver rimelig tvivl. En ny rapport fr
Fingeraftryk mangler videnskabeligt grundlag for retssikkerhedKredit:Carnegie Mellon University Det kan overraske mange, især dem, der er modtagelige for CSI-effekten, men fingeraftryksbeviser er ikke afgørende ud over enhver rimelig tvivl. En ny rapport fr -
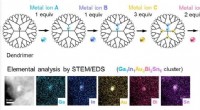 Gennembrud inden for blandingsmetaller-præcis styring af multimetallisk en-nanometer klyngedannelse…Fem metalelementer blandes her i en lille klynge på en nanometer skala. Kredit:Takamasa Tsukamoto Forskere i Japan har fundet en måde at skabe innovative materialer ved at blande metaller med præc
Gennembrud inden for blandingsmetaller-præcis styring af multimetallisk en-nanometer klyngedannelse…Fem metalelementer blandes her i en lille klynge på en nanometer skala. Kredit:Takamasa Tsukamoto Forskere i Japan har fundet en måde at skabe innovative materialer ved at blande metaller med præc -
 Musestudie identificerer ny forbindelse, der kan hjælpe med at udvikle diabetesmedicinKredit:CC0 Public Domain Forskning ledet af Ohio State University Wexner Medical Center og College of Medicine identificerede en ny forbindelse, der kan tjene som grundlag for at udvikle en ny kla
Musestudie identificerer ny forbindelse, der kan hjælpe med at udvikle diabetesmedicinKredit:CC0 Public Domain Forskning ledet af Ohio State University Wexner Medical Center og College of Medicine identificerede en ny forbindelse, der kan tjene som grundlag for at udvikle en ny kla -
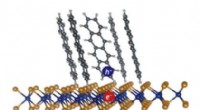 Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød
Hurtigt bevægende elektroner skaber strøm i organiske solcellerEn exciton (elektron-hul-par) dannet ved grænsefladen mellem tetracen-molekyler (en organisk halvleder) og enkeltlags WS2 (en uorganisk halvleder). Dissociation af sådanne grænseflade excitoner er nød
- Hvilke udtryk beskriver bedst typen af binding i magnesiumchlorid?
- Begyndelsen af handel i det nordvestlige Europa i bronzealderen
- CO2-affald skal omdannes til ingredienser til brændstof, plastik og endda mad
- Hvad tager planter ind og frigiver i miljøet?
- Hvad var vigtigheden af voltaisk bunke?
- Sådan Multipliceres og Divideres Blandede Brøker


