Er kogepunktet for klor lavere end vandet?
Her er hvorfor:
* klor (CL₂) er et ikke -polært molekyle: Klormolekyler holdes sammen af svage London -spredningskræfter. Disse kræfter er relativt svage sammenlignet med den hydrogenbinding, der er til stede i vand.
* vand (H₂O) er et polært molekyle: Vandmolekyler danner stærke brintbindinger med hinanden, hvilket kræver mere energi for at overvinde disse bindinger og nå kogepunktet.
kogepunkter:
* klor: -34,04 ° C (-29,47 ° F)
* Vand: 100 ° C (212 ° F)
 Varme artikler
Varme artikler
-
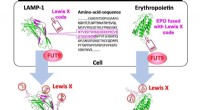 Forskerhold identificerer en molekylær kode indlejret i protein til regulering af dets glykosylerin…Specifik 29-aminosyresekvens fra LAMP-1 tjener som en Lewis X-kode, som dechifreres af FUT9, og den kan indlejres i erythropoietin for at fremkalde Lewis X-modifikation. Kredit:Nagoya City University
Forskerhold identificerer en molekylær kode indlejret i protein til regulering af dets glykosylerin…Specifik 29-aminosyresekvens fra LAMP-1 tjener som en Lewis X-kode, som dechifreres af FUT9, og den kan indlejres i erythropoietin for at fremkalde Lewis X-modifikation. Kredit:Nagoya City University -
 Ny metode gør det muligt at fotografere enzymerHvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn Forskere ved universitetet i Bonn har udviklet en me
Ny metode gør det muligt at fotografere enzymerHvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn Forskere ved universitetet i Bonn har udviklet en me -
 Et simpelt, billigt materiale til kulstoffangst, måske fra udstødningsrørKuldioxid (afbildet i rødt og hvidt til venstre) er den vigtigste drivhusgas, der opvarmer jorden og udledes i store mængder i røggasserne fra industri- og kraftværker. En ny metode til at fjerne CO2
Et simpelt, billigt materiale til kulstoffangst, måske fra udstødningsrørKuldioxid (afbildet i rødt og hvidt til venstre) er den vigtigste drivhusgas, der opvarmer jorden og udledes i store mængder i røggasserne fra industri- og kraftværker. En ny metode til at fjerne CO2 -
 Den mest komplette undersøgelse af batterifejl ser lysetForskere har skabt en ny teknik, der scanner tusindvis af partikler i elektroden på et batteri på én gang. Målet er at forstå, hvordan revner i disse partikler påvirker batteriets ydeevne, så industri
Den mest komplette undersøgelse af batterifejl ser lysetForskere har skabt en ny teknik, der scanner tusindvis af partikler i elektroden på et batteri på én gang. Målet er at forstå, hvordan revner i disse partikler påvirker batteriets ydeevne, så industri
- Topologiske materialer til informationsteknologi tilbyder tabsfri transmission af signaler
- Forskere finder kvæg- og næsehornsarter på tibetansk plateau omkring 5, 200 år siden
- Hvor meget forurener du din kontorluft bare ved at eksistere?
- Hvad er den samlede kinetiske energi af atomer og molekyler i et objekt kaldet?
- Spørgsmål og svar:Hvorfor drukner vi i engangsplastik, og hvad kan vi gøre ved det?
- Hvordan fungerer genbrug af polystyren?


