Hvad er en ikke -metallisk forbindelse?
Her er en sammenbrud:
* Metalliske elementer: Dette er elementer, der typisk er skinnende, formbare, duktile og gode ledere af varme og elektricitet. Eksempler inkluderer:
* Alkali -metaller (Li, Na, K, RB, CS, FR)
* Alkaliske jordmetaller (BE, MG, CA, SR, BA, RA)
* Overgangsmetaller (Fe, Cu, Au, AG osv.)
* Ikke-metalliske elementer: Dette er elementer, der mangler de typiske egenskaber ved metaller. De er ofte sprøde, kedelige og dårlige ledere. Eksempler inkluderer:
* Halogener (F, CL, BR, I, AT)
* Ædle gasser (He, NE, AR, KR, XE, RN)
* Oxygen, nitrogen, kulstof, svovl, fosfor osv.
Eksempler på ikke-metalliske forbindelser:
* vand (H₂O): Lavet af brint og ilt, begge ikke-metaller.
* kuldioxid (co₂): Lavet af kulstof og ilt.
* ammoniak (NH₃): Lavet af nitrogen og brint.
* sukker (c₁₂h₂₂o₁₁): Lavet af kulstof, brint og ilt.
* methan (ch₄): Lavet af kulstof og brint.
Nøgleegenskaber ved ikke-metalliske forbindelser:
* bred vifte af ejendomme: Ikke-metalliske forbindelser kan være faste stoffer, væsker eller gasser ved stuetemperatur. De kan have forskellige farver, densiteter og opløseligheder.
* forskellige applikationer: Ikke-metalliske forbindelser har utallige applikationer inden for forskellige felter, herunder:
* Farmaceutiske stoffer
* Landbrug
* Fremstilling
* Fødevareindustri
* Energiproduktion
Husk, at en forbindelse betragtes som ikke-metallisk, hvis den ikke indeholder nogen metalliske elementer i dens sammensætning.
Sidste artikelKemisk forbindelse dannet mellem lithium og svovl?
Næste artikelHvad er reaktionen af acetylen med brom?
 Varme artikler
Varme artikler
-
 Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte
Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte -
 Udrugbare sygdomme får et nyt værktøj til opdagelse af RNA-lægemidlerScripps forskningskemiker Matthew Disney, PhD, og kandidatstuderende Blessy Suresh i deres Jupiter, Florida laboratorium. Kredit:Scripps Research Forestil dig, at du prøver at kaste et blik, når d
Udrugbare sygdomme får et nyt værktøj til opdagelse af RNA-lægemidlerScripps forskningskemiker Matthew Disney, PhD, og kandidatstuderende Blessy Suresh i deres Jupiter, Florida laboratorium. Kredit:Scripps Research Forestil dig, at du prøver at kaste et blik, når d -
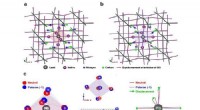 Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron
Skinner lys over spændingstilstande i perovskitmaterialerTeoretisk forudsagte strukturer af MAPbI 3 hybrid perovskit:en neutral klynge. b negativt ladet (polaron) klynge. c Forskellige perspektivlige sammenligninger af den neutrale (røde sfære) og polaron -
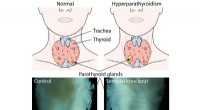 Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
- Nyt værktøj til at hjælpe byggeindustrien med at reducere CO2-fodaftrykket
- Hvilken energi overføres ved direkte kontakt eller berøring?
- Kemisk og optisk billeddannelse forklarer, hvorfor en rose mistede sin farve i et berømt maleri
- Hvordan kan solen påvirke jorden?
- Hvordan reagerer ikke -metaller med vand?
- Rapporten opfordrer til radikal genovervejelse af støtten til løsladte fanger, der kommer sig fra …


