Hvad er et stof, der fremskynder kemisk proces?
Her er en sammenbrud:
* katalysator: Et stof, der øger hastigheden for en kemisk reaktion uden at blive konsumeret i processen. Det giver en alternativ vej med en lavere aktiveringsenergi, hvilket får reaktionen til at forekomme hurtigere.
* Aktiveringsenergi: Den mindste mængde energi, der kræves for at en reaktion kan forekomme. Katalysatorer sænker denne energibarriere.
Eksempler på katalysatorer:
* enzymer: Biologiske katalysatorer, der fremskynder biokemiske reaktioner i levende organismer.
* Metaller: Mange metaller som platin, nikkel og palladium bruges som katalysatorer i industrielle processer.
* syrer og baser: Kan fungere som katalysatorer i visse reaktioner.
Nøglepunkter:
* Katalysatorer forbruges ikke i reaktionen.
* De kan bruges gentagne gange.
* Katalysatorer ændrer ikke ligevægtspositionen for en reversibel reaktion; De fremskynder simpelthen reaktionshastigheden.
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Hvordan ioner samler vandmolekyler omkring demBochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler
Hvordan ioner samler vandmolekyler omkring demBochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler -
 Maskinlæringsmetoder giver ny indsigt i organisk-uorganiske grænsefladerVed at kombinere to nye maskinlæringsmetoder, TU Graz fysiker Oliver Hofmann var i stand til at tilbagevise teorier om lang rækkevidde ladningsoverførsel mellem organiske og uorganiske materialer. Kre
Maskinlæringsmetoder giver ny indsigt i organisk-uorganiske grænsefladerVed at kombinere to nye maskinlæringsmetoder, TU Graz fysiker Oliver Hofmann var i stand til at tilbagevise teorier om lang rækkevidde ladningsoverførsel mellem organiske og uorganiske materialer. Kre -
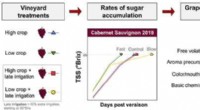 At bremse modningen af druer kan forbedre bærkvaliteten til vinfremstillingKredit:American Chemical Society Vindruer er særligt kræsne, når det kommer til deres miljø. For eksempel, hedebølger og tørke fører til tidligere bærmodning og glansløs vin. Og disse typer episod
At bremse modningen af druer kan forbedre bærkvaliteten til vinfremstillingKredit:American Chemical Society Vindruer er særligt kræsne, når det kommer til deres miljø. For eksempel, hedebølger og tørke fører til tidligere bærmodning og glansløs vin. Og disse typer episod -
 Den grundlæggende kemi bag elektrokatalytisk vandspaltningOxygen evolution reaktion. Kredit:Matthias Frei, ETH Zürich Overgang til en bæredygtig energiøkonomi kræver elektrokatalytiske metoder til at konvertere elektrisk energi til kemisk energi og råsto
Den grundlæggende kemi bag elektrokatalytisk vandspaltningOxygen evolution reaktion. Kredit:Matthias Frei, ETH Zürich Overgang til en bæredygtig energiøkonomi kræver elektrokatalytiske metoder til at konvertere elektrisk energi til kemisk energi og råsto
- Bevæger natrium- og chloridioner rundt parvis, når opløsningen?
- Vildtyr udgør en stor trussel mod Outback, undersøgelser af klimaændringer finder
- En erklæring om solen fra del A er Corona varmere end fotosfæren, hvilken af følgende udsagn gi…
- Dyrlæger udfører den første kendte hjernekirurgi for at behandle hydrocephalus hos pelssæl
- Den elektrostatiske kraft mellem to ladninger, der er placeret 2 meter fra hinanden, er 0,10N. Hvad …
- Hvad er forskellige) i en snøskred og jordskred?


