Kan væsker og faststof komprimeres?
væsker:
* komprimerbar, men mindre end gasser: Væsker er meget mindre komprimerbare end gasser, fordi deres molekyler er meget tættere sammen. De er dog stadig komprimerbare til en vis grad.
* komprimering afhænger af pres: Mængden af komprimering afhænger af det anvendte tryk. Højere tryk fører til større komprimering.
* Eksempler: Hydrauliske systemer bruger kompressibiliteten af væsker til at transmittere kraft, og dybhavsorganismer har tilpasset sig til at modstå det enorme tryk på havdybderne.
faste stoffer:
* generelt mindre komprimerbar end væsker: Faststoffer er endnu mindre komprimerbare end væsker, fordi deres molekyler holdes i faste positioner, hvilket gør dem mere stive.
* kompressibilitet varierer meget: Forskellige faste stoffer har forskellige kompressibiliteter, afhængigt af faktorer som typen af binding mellem atomer og arrangementet af atomer i det faste stof.
* Eksempler: Metaller er relativt ukomprimerbare, mens gummi er mere komprimerbar.
Nøgleforskelle i kompressibilitet:
* Intermolekylær afstand: Jo tættere molekylerne er, desto mindre komprimerbart er stoffet. Gasser har den største afstand, efterfulgt af væsker og derefter faste stoffer.
* kræfter mellem molekyler: Stærkere intermolekylære kræfter gør et stof mindre komprimerbart.
* Matterilat: Gasser er de mest komprimerbare, væsker er mindre komprimerbare, og faste stoffer er de mindst komprimerbare.
Kortfattet:
Både væsker og faste stoffer kan komprimeres, men væsker er mere komprimerbare end faste stoffer. Kompressibiliteten af både væsker og faste stoffer afhænger af faktorer som det påførte tryk og stoffets iboende egenskaber.
Sidste artikelHvad øges i volumenet af et stof, når temperaturen øges?
Næste artikelHvilken forbindelse er et salt?
 Varme artikler
Varme artikler
-
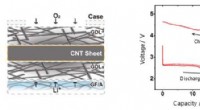 Udvikling af lithium-luft-batterier med ultrahøj kapacitet ved brug af CNT-arkluftelektroderKonceptuelt diagram af en CNT-arkluftelektrode (venstre) og opladnings-afladningskarakteristika for lithium-luftbatteriet med ultrahøj kapacitet (højre). Kredit:National Institute for Materials Scienc
Udvikling af lithium-luft-batterier med ultrahøj kapacitet ved brug af CNT-arkluftelektroderKonceptuelt diagram af en CNT-arkluftelektrode (venstre) og opladnings-afladningskarakteristika for lithium-luftbatteriet med ultrahøj kapacitet (højre). Kredit:National Institute for Materials Scienc -
 Katalysator omdanner plastaffald til værdifulde ingredienser ved lav temperaturKredit:Osaka City University For første gang, forskere har brugt en ny katalysatorproces til at genbruge en type plastik, der findes i alt fra indkøbsposer og fødevareemballage til legetøj og elek
Katalysator omdanner plastaffald til værdifulde ingredienser ved lav temperaturKredit:Osaka City University For første gang, forskere har brugt en ny katalysatorproces til at genbruge en type plastik, der findes i alt fra indkøbsposer og fødevareemballage til legetøj og elek -
 Video:Kunne der være liv uden kulstof?Kredit:The American Chemical Society Et element er rygraden i alle former for liv, vi nogensinde har opdaget på Jorden:kulstof. Nummer seks i det periodiske system er, så vidt vi ved, umuligt at
Video:Kunne der være liv uden kulstof?Kredit:The American Chemical Society Et element er rygraden i alle former for liv, vi nogensinde har opdaget på Jorden:kulstof. Nummer seks i det periodiske system er, så vidt vi ved, umuligt at -
 Hvad sker der, når du eksploderer en kemisk binding?UC Berkeley-forskere undersøger de flygtige trin i hurtige fotokemiske reaktioner med nogle af de korteste laserimpulser, der er mulige i dag. I dette tilfælde, en femtosekundspuls af synligt lys (grø
Hvad sker der, når du eksploderer en kemisk binding?UC Berkeley-forskere undersøger de flygtige trin i hurtige fotokemiske reaktioner med nogle af de korteste laserimpulser, der er mulige i dag. I dette tilfælde, en femtosekundspuls af synligt lys (grø
- Hvad udvikler bruger elektricitet til at producere mekanisk energi?
- Livscyklus for en hval
- Giftige PCB'er bliver hængende i skolerne; EPA, lovgivere undlader at handle
- Hvad fortæller dig, hvor mange atomer af en reaktant eller et produkt, der deltager i reaktion?
- Moderen til alle bomber er stor, men den er ikke nuke
- Hvordan indkommende adenovira ændrer deres kromatinstruktur for effektiv genekspression


