Hvilket stof producerede hydroxidioner i vand?
* Stærke baser: Disse ioniseres fuldstændigt i vand og frigiver et stort antal hydroxidioner. Almindelige eksempler inkluderer:
* Gruppe 1 Hydroxider (f.eks. NaOH - natriumhydroxid, KOH - kaliumhydroxid)
* Gruppe 2 Hydroxider (f.eks. Ca (OH) 2 - Calciumhydroxid, BA (OH) 2 - Bariumhydroxid)
* svage baser: Disse ioniserer kun delvist i vand og frigiver færre hydroxidioner. Almindelige eksempler inkluderer:
* Ammoniak (NH3)
* Metaloxider (f.eks. MgO - magnesiumoxid, Cuo - kobber (II) oxid)
* Nogle organiske forbindelser (f.eks. Aminer)
hvordan de fungerer:
Når en base opløses i vand, donerer den hydroxidioner (OH-) til opløsningen. Dette øger koncentrationen af hydroxidioner, hvilket gør opløsningen mere alkalisk.
Vigtig note: Tilstedeværelsen af hydroxidioner er en nøgleegenskab ved alkaliske opløsninger, og det er det, der giver dem deres grundlæggende egenskaber.
 Varme artikler
Varme artikler
-
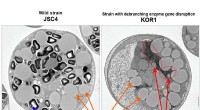 Ændring af kulhydrater til lipider til mikroalger biobrændstofferFigur 1:Elektronmikroskopbillede af lipidproduktion i mikroalgerne Chlamydomonas sp. Kredit:Kobe University Et tværinstitutionelt samarbejde har udviklet en teknik til at fordele kulstofressourcer
Ændring af kulhydrater til lipider til mikroalger biobrændstofferFigur 1:Elektronmikroskopbillede af lipidproduktion i mikroalgerne Chlamydomonas sp. Kredit:Kobe University Et tværinstitutionelt samarbejde har udviklet en teknik til at fordele kulstofressourcer -
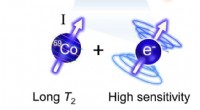 Kemikere designer kemisk sonde til at registrere små temperaturændringer i kroppenKredit:Colorado State University Den ikke-invasive, livreddende teknik kendt som magnetisk resonansbilleddannelse virker ved at justere brintatomer i et stærkt magnetfelt og pulserende radiofrekven
Kemikere designer kemisk sonde til at registrere små temperaturændringer i kroppenKredit:Colorado State University Den ikke-invasive, livreddende teknik kendt som magnetisk resonansbilleddannelse virker ved at justere brintatomer i et stærkt magnetfelt og pulserende radiofrekven -
 Forskere rydder bane for tinbaserede perovskit-solcellerKredit:CC0 Public Domain Forskere ved University of Surrey mener, at deres tinbaserede perovskit-solcelle kan rydde banen for solpanelteknologi til at tage fart og hjælpe Storbritannien med at nå
Forskere rydder bane for tinbaserede perovskit-solcellerKredit:CC0 Public Domain Forskere ved University of Surrey mener, at deres tinbaserede perovskit-solcelle kan rydde banen for solpanelteknologi til at tage fart og hjælpe Storbritannien med at nå -
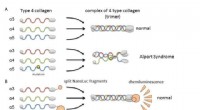 Et meget følsomt og multianalytisk system til arvelig nyresygdom(A) Kollagen IV alfa-3, alfa-4, og alfa-5 danner normalt komplekser (trimere) og bliver bestanddele af basalmembranen i nyren. Ved Alport syndrom, genetisk mutation i en af kæderne forstyrrer trimer
Et meget følsomt og multianalytisk system til arvelig nyresygdom(A) Kollagen IV alfa-3, alfa-4, og alfa-5 danner normalt komplekser (trimere) og bliver bestanddele af basalmembranen i nyren. Ved Alport syndrom, genetisk mutation i en af kæderne forstyrrer trimer
- Hvad er den kovalente binding af CO2?
- Produktspredning virker muligvis ikke for visse produkter
- Babystjerner, dansende galakser:NASA viser nye kosmiske udsigter
- Hvordan flytter du vand fra en kop til en anden uden at bruge nogen energikilde?
- Stephen Hawking, den overmenneskelige popkulturstjerne
- Hvornår blev rundrejsen til Mars oprettet?


