Når der kaldes små attraktioner, der udvikler sig mellem modsat ladede regioner i nærliggende molekyler?
Disse kræfter er en type svag, ikke-kovalent interaktion, der opstår fra midlertidige udsving i elektronfordeling omkring molekyler. Der er tre hovedtyper af van der Waals -styrker:
* London Dispersion Forces: Disse forekommer mellem alle molekyler, endda ikke -polære, på grund af midlertidige udsving i elektronskyer.
* dipol-dipolinteraktioner: Disse forekommer mellem polære molekyler på grund af de permanente delvise ladninger på deres atomer.
* dipole-inducerede dipolinteraktioner: Disse forekommer, når et polært molekyle inducerer en midlertidig dipol i et ikke -polært molekyle.
Mens de individuelt svage, kan van der Waals -kræfter være signifikante i stort antal, især for større molekyler med mange atomer. De spiller en afgørende rolle i mange biologiske processer, såsom proteinfoldning og dannelsen af cellemembraner.
Sidste artikelHvad er en atomobligation?
Næste artikelHvilke fedtsyrer har ikke dobbeltbindinger mellem kulhydrater?
 Varme artikler
Varme artikler
-
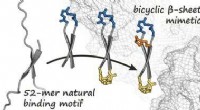 Cykliske protein-mimetika hæmmer onkogenet β-cateninKredit:Wiley Hæmningen af patologiske protein-protein-interaktioner er en lovende tilgang til behandling af et stort antal sygdomme, herunder mange former for kræft. Et team af forskere har nu u
Cykliske protein-mimetika hæmmer onkogenet β-cateninKredit:Wiley Hæmningen af patologiske protein-protein-interaktioner er en lovende tilgang til behandling af et stort antal sygdomme, herunder mange former for kræft. Et team af forskere har nu u -
 Styring af kemiske reaktioner nær det absolutte nulKredit:CC0 Public Domain Det er en underdrivelse at sige, at kemiske reaktioner finder sted overalt, konstant. Både i naturen og i laboratoriet, kemi er allestedsnærværende. Men på trods af fremsk
Styring af kemiske reaktioner nær det absolutte nulKredit:CC0 Public Domain Det er en underdrivelse at sige, at kemiske reaktioner finder sted overalt, konstant. Både i naturen og i laboratoriet, kemi er allestedsnærværende. Men på trods af fremsk -
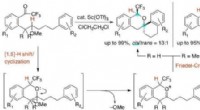 Ny syntese af komplekse organiske molekyler afsløretVi udviklede en effektiv metode til diastereoselektiv syntese af CF3-substituerede spiroisochromaner via C(sp3)¬-H-bindingsfunktionalisering, der involverer sekventielle transformationer ([1, 5] -hydr
Ny syntese af komplekse organiske molekyler afsløretVi udviklede en effektiv metode til diastereoselektiv syntese af CF3-substituerede spiroisochromaner via C(sp3)¬-H-bindingsfunktionalisering, der involverer sekventielle transformationer ([1, 5] -hydr -
 Forskere skræddersyr E. coli til at omdanne planter til vedvarende kemikalierSandia National Laboratories forskere Seema Singh, venstre; og Fang Liu holder hætteglas med vanillin og gæringsbouillon, som er afgørende for at omdanne plantemateriale til biobrændstoffer og andre v
Forskere skræddersyr E. coli til at omdanne planter til vedvarende kemikalierSandia National Laboratories forskere Seema Singh, venstre; og Fang Liu holder hætteglas med vanillin og gæringsbouillon, som er afgørende for at omdanne plantemateriale til biobrændstoffer og andre v
- Hvad er Sceince og Tchnology?
- Ny videnskab antyder, at vi snart kan være i stand til at blande computere og neuroner
- Astronauten og månevandreren Alan Bean dør i en alder af 86
- Hvad er den teoretiske masse af xenon tetrafluorid, der skal dannes, når 130 g reagerede med 100 F2…
- I kunstig selektion giver mennesker det selektive pres for arter til at ændre og forme udviklingen …
- Madoliebelægning forhindrer bakterier i at vokse på fødevareforarbejdningsudstyr


