Cykliske protein-mimetika hæmmer onkogenet β-catenin
Kredit:Wiley
Hæmningen af patologiske protein-protein-interaktioner er en lovende tilgang til behandling af et stort antal sygdomme, herunder mange former for kræft. Et team af forskere har nu udviklet et bicyklisk peptid, der binder sig til β-catenin-et protein forbundet med visse typer tumorer. Hemmeligheden bag deres succes er den cykliske natur og hårnåleformen af peptidet, som efterligner en naturlig proteinstruktur, de rapporterer i journalen Angewandte Chemie .
På grund af de omfattende proteinområder, der er involveret i protein-protein-interaktioner, terapeutiske tilgange, der involverer små molekyler, er ofte uden succes. Proteinmimetika er alternativer, der efterligner den rumlige struktur af bindingssegmenter af naturlige proteinbindingspartnere. Selvom β-sheets - proteinstrukturer lavet af flere udstrakte peptidkæder arrangeret side om side, ligner et ark papir foldet som et harmonika - spiller ofte en rolle i interaktionen mellem proteiner, de er sjældent blevet brugt som grundlag for mimetik. Dette skyldes delvist, at de har problemer med at komme ind i målcellen, og dermed, ikke kan nå det patogene protein.
Anført af Tom N. Grossmann, et internationalt team fra Vrije Universiteit Amsterdam (Holland), Università degli Studi di Napoli "Federico II" (Italien), samt AstraZeneca (Cambridge, Storbritannien), har nu rapporteret designet af β-sheet-mimetika, der hæmmer det intracellulære onkogene protein β-catenin. β-Catenin er en komponent i Wnt-signalvejen og aktiverer T-cellefaktorer (TCF), som i sidste ende stimulerer cellevækst og spredning. Hyperaktivering af Wnt-vejen er forbundet med forskellige former for cancer. Hæmning af interaktionen mellem β-catenin og TCF er således en tiltalende terapeutisk tilgang.
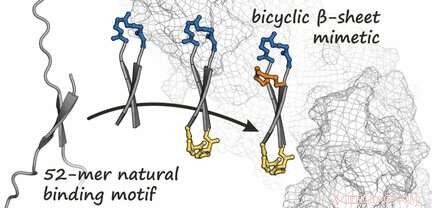
Baseret på den kendte struktur af β-catenin, når det er i et kompleks med et protein, holdet producerede først en bindingspartner til β-catenin. Denne partner er et ringformet peptid, der danner en kort, antiparallelt β-ark-kendt som en β-hårnålestruktur-når det er bundet til β-catenin, som vist ved en analyse af dens krystalstruktur. Ideen var at fiksere dette cykliske peptid i hårnåleformen ved at indføre en ekstra bro. Dette genererer en bicyklisk struktur, der styrker bindingen til β-catenin. Ved at bruge en række forskellige syntetiserede varianter, holdet var i stand til at identificere flere bicykliske peptider med høj affinitet for β-catenin. Imellem disse, de fandt en forbindelse, der (bortset fra det originale cykliske peptid) med succes trænger ind i celler og signifikant hæmmer den onkogene Wnt-signalkaskade.
Denne nyudviklede bicykliske β-ark-mimetik repræsenterer således et muligt udgangspunkt for udviklingen af nye antitumorlægemidler, der hæmmer cellulær Wnt-signalering. Denne strategi kan også bruges til design af yderligere hæmmere af andre protein-protein-interaktioner medieret af β-ark.
 Varme artikler
Varme artikler
-
 Flydende saltvand over denne superhydrofobe overflade kan generere elektricitetSEM-billeder af den superhydrofobe overflade Kredit: Naturkommunikation Ingeniører ved University of California San Diego har udviklet en superhydrofob overflade, der kan bruges til at generere e
Flydende saltvand over denne superhydrofobe overflade kan generere elektricitetSEM-billeder af den superhydrofobe overflade Kredit: Naturkommunikation Ingeniører ved University of California San Diego har udviklet en superhydrofob overflade, der kan bruges til at generere e -
 Konvertering af PPM til MicromolesDele pr. million (ppm) er en koncentrationsenhed. Når koncentrationen af et stof er lav, såsom vand forurenet med visse metaller (jern, cadmium eller magnesium), bliver ppm mere praktisk end stan
Konvertering af PPM til MicromolesDele pr. million (ppm) er en koncentrationsenhed. Når koncentrationen af et stof er lav, såsom vand forurenet med visse metaller (jern, cadmium eller magnesium), bliver ppm mere praktisk end stan -
 Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494 Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektro
Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494 Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektro -
 sekvensering, mRNA, eller måske nanokrystaller? Vidt åbent felt til Nobels KemiprisKemi Nobel er den tredje, der bliver uddelt i denne uge, efter medicin og fysik. Gennembrud i DNA-sekventering, innovativ gaslagring, nanokrystaller eller en ny chance for mRNA Covid-19-vacciner?
sekvensering, mRNA, eller måske nanokrystaller? Vidt åbent felt til Nobels KemiprisKemi Nobel er den tredje, der bliver uddelt i denne uge, efter medicin og fysik. Gennembrud i DNA-sekventering, innovativ gaslagring, nanokrystaller eller en ny chance for mRNA Covid-19-vacciner?
- Atomenergiprogrammer øger ikke sandsynligheden for spredning, undersøgelse finder
- Olieindustrien under pres for at reagere på klimaændringer
- Det er en myte, at drenge har slået piger i A-niveau resultater
- Internets grundlægger vil nu reparere nettet, men hans forslag savner målet
- Ny type silicium lover billigere solteknologi
- Affaldsplast i beton kan understøtte bæredygtigt byggeri i Indien


