Genet af Leishmania afslører, hvordan denne parasit tilpasser sig miljøændringer
Kredit:Center for Genomisk Regulering
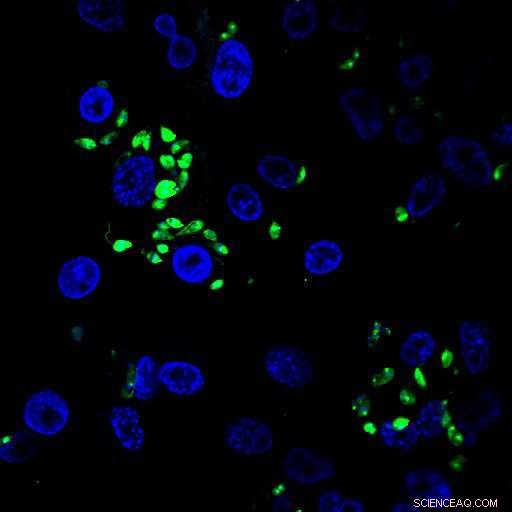
Leishmaniasis er en vigtig menneskelig og veterinær sygdom forårsaget af Leishmania -parasitter, der påvirker 12 millioner mennesker i over 98 endemiske lande. Sygdommen dukker nu op i Europa på grund af klimaændringer og massiv befolkningsforskydning. Parasitten er kendt for hurtigt at tilpasse sig nye miljøer med vigtige konsekvenser for sygdomsudfaldet. Det er derfor blevet anerkendt som en voksende trussel mod folkesundheden for EU.
I et papir, udgivet i Naturøkologi og evolution , forskere fra Institut Pasteur i Paris og Center for Genomisk Regulering (CRG) i Barcelona, i samarbejde med teams ved Institute of Tropical Medicine Antwerp (ITM) og University of Montpellier, har nu vist, at Leishmania -tilpasning skyldes hyppige og reversible kromosomale amplifikationer. Sådanne variationer, navngivne aneuploidier, ligner dem, der forekommer i mange kræftformer.
Disse fund repræsenterer et vigtigt skridt i retning af en bedre forståelse af menneskelig Leishmania -infektion, med relevans for parasitlægemiddelresistens, patogenicitet, og vævstropisme. Denne nye indsigt i Leishmania genomisk ustabilitet bør bane vejen for identifikation af parasitmedicinresistensmekanismer i klinisk relevante indstillinger og hjælpe med at opdage biomarkører med diagnostisk og prognostisk værdi.
Leishmaniasis er blandt de fem vigtigste parasitære sygdomme på verdensplan, med anslået 350 millioner mennesker i risiko for infektion. Sygdommen forårsager et spektrum af kliniske manifestationer, der spænder fra disfiguring cutaneous til fatale viscerale former, som skyldes infektion med forskellige arter af Leishmania -parasitter. Disse encellede parasitter tilpasser sig et bemærkelsesværdigt udvalg af værter. De vokser som ekstracellulære parasitter inde i phlebotominsandfluer, der overfører Leishmania til forskellige hvirveldyr, såsom gnavere, hunde, og mennesker, hvor de vokser inde i immunceller, især makrofager, forårsager alvorlige patologier, der kan føre til døden.
Leishmaniasis er en af de mest forsømte sygdomme og tiltrækker som følge heraf begrænset opmærksomhed. Der er ingen human vaccine, og kun få behandlinger er tilgængelige, som alle viser en eller flere vigtige begrænsninger med hensyn til administration, toksicitet eller omkostninger. Værre endnu, et kendetegn ved Leishmania -biologien er tilfældigvis dens evne til at tilpasse sig en række uforudsigelige udsving i dens menneskelige vært, især farmakologiske interventioner, med vigtige konsekvenser for sygdomsudfaldet som vist ved fremkomsten af lægemiddelresistente kliniske isolater.
For at identificere de genetiske mekanismer, der driver Leishmania genomisk tilpasning, forskere fra Institut Pasteur i Paris og Center for Genomisk Regulering (CRG) i Barcelona, i samarbejde med teams ved Institute of Tropical Medicine Antwerp (ITM) og University of Montpellier har udviklet nye teknikker til komparativ genomik, baseret på næste generations sekventering og in-silico analyser. Deres arbejde, som udgives i Naturøkologi og evolution , viser for første gang eksistensen i Leishmania af en sammenhæng mellem ændringer i kromosomkopienummer og udvælgelsen af nye alleler, der er vigtige for parasitoverlevelse.
Det mest overraskende aspekt af dette arbejde er iagttagelsen af, at Leishmania formår at kombinere allelselektion med opretholdelse af en høj genetisk mangfoldighed. Normalt bør disse to processer udelukke hinanden, og man ville forvente, at en parasit under stærkt udvalg hurtigt ville miste sin genetiske mangfoldighed. I Leishmania, imidlertid, de meget hyppige kromosomale dubleringer gør det muligt at kombinere begge dele. Ja, parasitten bevarer sin mangfoldighed ved at tillade, at den samme kombination af alleler vælges samtidigt i genetisk mangfoldige individer.
Gerald Späth, Direktør for Molecular Parasitology and Signaling Unit ved Institut Pasteur i Paris, der ledede den eksperimentelle del af denne undersøgelse, kommentarer:"Grundlæggende, anvendt, og klinisk forskning i Leishmania udføres næsten udelukkende ved hjælp af parasitter fra langtidskultur. Vores undersøgelse viser, at parasitgenomet udvikler sig meget hurtigt under laboratorieforhold. Dette skal overvejes, når man studerer parasitbiologien og søger efter nye biomarkører, medicin, eller vaccinkandidater. Fremtiden for Leishmania -forskning bør udføres på en mere integreret måde, i betragtning af de komplekse genetiske interaktioner mellem parasitter, hvirveldyr vært og insekt vektor, og under klinisk relevante forhold, for eksempel ved hjælp af parasitter fra kortvarig kultur eller anvendelse af direkte vævs sekventering ".
Cedric Notredame, Seniorforsker ved Center for Genomisk Regulering i Barcelona, der ledede den komparative genomiske del af denne undersøgelse, forklarer:"Forestillingen om, at genamplifikation er en motorvej til tilpasning, har længe eksisteret, men vores arbejde viser, at i Leishmania, evolution har opskaleret denne mekanisme til det punkt, at den er en væsentlig del af parasitens livscyklus. En stigende mængde arbejde viser, at lignende komplekse aneuploidi -variationer spiller en rolle i nogle former for kræft, og vi tror, at den hurtige akkumulering af NGS -genomiske data kombineret med nye in -silico -teknikker - ligesom dem udviklet i vores undersøgelse - snart vil føre til en bedre forståelse af forholdet mellem aneuploidi og allelselektion ".
Professor Jean-Claude Dujardin fra ITM påpeger:"Det tog os mere end fem år at indsamle et hidtil uset sekventeringsdatasæt fra kliniske isolater på det indiske subkontinent og offentliggøre en første analyse sidste år. Et stort træk ved moderne videnskab er, at alle sekventeringsdata skal offentliggøres, som tillader nye samarbejder og undersøgelser som vores. Det tillod også etablering af en ny alliance mellem ITM, Institut Pasteur og CRG i kampen mod infektionssygdomme. "
Resultaterne af denne originale undersøgelse er yderst relevante for andre menneskelige sygdomme, der er afhængige af genomets ustabilitet, såsom svampeinfektion eller kræft, og åbne nye steder for anti-leishmanial opdagelse af lægemidler ved hjælp af værtstyrede strategier, der retter sig mod parasitens metaboliske afhængighed af værtscellen, og dermed forhindre adaptiv udvikling af lægemiddelresistente parasitter.
Baseret på resultaterne offentliggjort i denne artikel, og med det formål at studere biologi og epidemiologi ved Leishmania i en klinisk mere relevant kontekst, Dr. Gerald Späth etablerede det internationale konsortium 'LeiSHield', der koordinerer en fælles indsats mellem partnerhold i Institut Pasteur International Network og videre, som oprindeligt blev støttet af en såningskasse fra Institut Pasteur International Direction, og er nu finansieret af et 1,7 millioner euro -tilskud fra EU H2020 -programmet.
Sidste artikelRasende debat:Bremser ulv bremse krybskytteri?
Næste artikelNy opdagelse:Almindelige vandmænd er faktisk to arter
 Varme artikler
Varme artikler
-
 Undersøgelse kaster nyt lys over overlevelse af krilllarverHavisen spiller en væsentlig rolle i at beskytte krilllarverne mod prædation. Kredit:Ulrich Freier @ AWI En international undersøgelse, der involverer forskere fra British Antarctic Survey (BAS) h
Undersøgelse kaster nyt lys over overlevelse af krilllarverHavisen spiller en væsentlig rolle i at beskytte krilllarverne mod prædation. Kredit:Ulrich Freier @ AWI En international undersøgelse, der involverer forskere fra British Antarctic Survey (BAS) h -
 Forbløffende mangfoldighed af arter rapporteret om Solent østers restaureringsprojektEn ung søhest. Kredit:University of Portsmouth En overraskende mangfoldighed af arter, herunder søheste og kritisk truede ål, er blevet rapporteret i Solent. De er blevet fundet i østersbursystem
Forbløffende mangfoldighed af arter rapporteret om Solent østers restaureringsprojektEn ung søhest. Kredit:University of Portsmouth En overraskende mangfoldighed af arter, herunder søheste og kritisk truede ål, er blevet rapporteret i Solent. De er blevet fundet i østersbursystem -
 Bekymringsvinde:Amerikanske fiskere frygter skove af kraftturbinerI denne mandag, 15. august, 2016, fil foto tre vindmøller fra Deepwater Wind-projektet står i Atlanterhavet ud for Block Island, R.I. Fishermen vender et forsigtigt øje mod en ny opkomling:havvindindu
Bekymringsvinde:Amerikanske fiskere frygter skove af kraftturbinerI denne mandag, 15. august, 2016, fil foto tre vindmøller fra Deepwater Wind-projektet står i Atlanterhavet ud for Block Island, R.I. Fishermen vender et forsigtigt øje mod en ny opkomling:havvindindu -
 Hvilken firkant er størst? Honningbier ser visuelle illusioner ligesom mennesker gørBlomster kan drage fordel af visuelle illusioner til at tiltrække bier. Kredit:www.shutterstock.com Når et menneske ser på en fjern skyskraber, det ser lille ud for øjet. Det er en visuel illusion
Hvilken firkant er størst? Honningbier ser visuelle illusioner ligesom mennesker gørBlomster kan drage fordel af visuelle illusioner til at tiltrække bier. Kredit:www.shutterstock.com Når et menneske ser på en fjern skyskraber, det ser lille ud for øjet. Det er en visuel illusion
- Undersøger mikroskopiske wiggles i squishy materialer
- Hvis vores plan mislykkes, kan vi improvisere?
- Undersøgelse finder kløften mellem rig og fattig, der vokser regionalt, også
- Forskere ser på tidligere databehandlinger for at låse op for 3-D-printede mekaniske logiske porte…
- Sådan måles intensiteten af en Flood
- Facebook ansætter højtstående advokat i det amerikanske udenrigsministerium


