Afrikansk sovesyge:Hvordan patogenet koloniserer tsetse-fluer
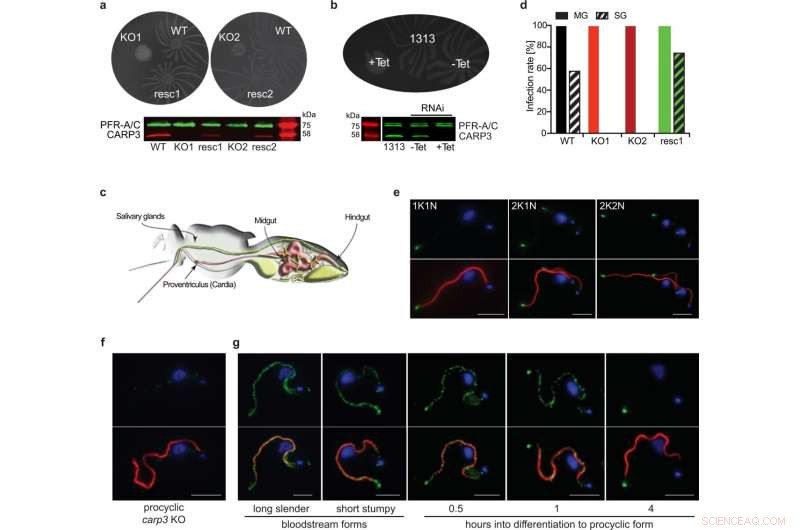
CARP3 er en flagelspidsregulator af social motilitet (SoMo) og er afgørende for kolonisering af tsetseflues spytkirtler. a SoMo-assays af procyklisk T. brucei AnTat 1.1-vildtype (WT), carp3-knock-out (KO, uafhængige kloner KO1, KO2) eller in situ CARP3-redning (resc, uafhængige kloner resc1, resc2). Western blot blev probet med anti-CARP3 og anti-PFR-A/C (belastningskontrol). b SoMo-assay på tetracyclin (Tet)-inducerbart RNAi af CARP3 (-Tet / +Tet 24 h) og den parentale AnTat 1.1 1313-cellelinje. Western blot viser CARP3-undertrykkelse detekteret af antistoffer som i (a). c Illustration af fordøjelsessystemet og spytkirtlerne hos en tsetseflue (tilpasset fra91). d Infektionshastigheder af tsetseflue-midtarm (MG) eller spytkirtler (SG) med T. brucei AnTat 1.1-cellelinjer som i (a). Fluer blev dissekeret 34-36 dage p.i., n (fluer) =48 (WT), 50 (KO1), 50 (KO2), 40 (resc1). 10 mM L-glutathion blev inkluderet i blodmåltidet (Institute of Tropical Medicine Antwerp tsetse fluekoloni). Indirekte immunfluorescensanalyse af CARP3 (grøn) i T. brucei AnTat 1.1 procyklisk form WT (e) eller carp3 KO (f). De øverste paneler viser CARP3 (grøn) og det nukleare og mitokondrielle DNA farvet med DAPI (blåt), de nederste paneler viser et overlejring med axonemet (rødt; farvet med antistoffet mAB25). I (e) vises celler i forskellige cellecyklusstadier (1K1N, 2K1N, 2K2N; K kinetoplast, N-kerne). g Indirekte immunfluorescensanalyse af CARP3 (grøn) som i (e, f) under kulturdifferentiering fra blodbanen til procykliske former. Målestok i (e–g) 5 µm. Kildedata til (a, b) og (d) leveres som kildedatafil. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-33108-z
LMU-forskere har dechifreret en afgørende signalmekanisme, der gør det muligt for trypanosomer at nå fluernes spytkirtler.
Tsetse-fluer er almindelige i store dele af Afrika. De lever af blod fra mennesker og andre dyr. I processen kan de overføre trypanosomer, en protozoisk parasit. Trypanosoma brucei forårsager sovesyge hos mennesker. Patogener infiltrerer værten gennem spyttet fra inficerede tsetsefluer:Fra blodet når de hjernen, hvilket fører til dødelige symptomer, hvis de ikke behandles.
Men hvordan kommer trypanosomer ind i spytkirtlerne på tsetsefluer efter deres blodmåltid? Dr. Sabine Bachmaier og professor Michael Boshart fra Genetik-afdelingen ved LMU's Biologiske Fakultet har sammen med videnskabelige kolleger fundet et overraskende svar på dette spørgsmål.
De viser, at et signalapparat ved flagelspidsen af protozoerne styrer migrationen af trypanosomer i tsetsefluen via budbringeren kendt som cyklisk adenosinmonofosfat (cAMP). Fjernelsen af en komponent af enzymkomplekset, der producerer cAMP-signalmolekylet, var tilstrækkelig til at forhindre infektion af fluerne. Resultaterne af undersøgelsen er nu blevet offentliggjort i Nature Communications .
Indsigt i det regulatoriske netværk
Som baggrund:Kvæg og antiloper er naturlige reservoirer af Trypanosoma brucei. Under et blodmåltid kommer patogener ind i mave-tarmkanalen på tsetsefluer. For at overleve og forplante sig yderligere, skal trypanosomer tilpasse sig deres skiftende miljø. De migrerer frem og tilbage mellem blodbanen og vævene i en pattedyrvært og mellem fordøjelseskanalen og spytkirtlerne på en tsetseflue, hvorved de passerer gennem en række udviklingsstadier.
"Vores projekt er baseret på flere internationale samarbejder med forskningsgrupper i Paris, Antwerpen og Rio de Janeiro," siger Bachmaier. "Vi havde længe været interesseret i spørgsmålet om, hvordan parasitter formår at orientere sig i tsetsefluen - og hvordan dette kunne forhindres for at kontrollere overførsel af sygdommen."
For omkring ti år siden identificerede forskergruppen en ny og trypanosom-specifik komponent af cAMP-signalvejen - det cykliske AMP-responsprotein 3 (CARP3). "Vores opdagelse af, at CARP3 primært findes i spidsen af flagellaen af trypanosomer, satte os på duften af et specialiseret signalapparat til orientering af parasitterne i tsetsefluen," siger Bachmaier.
Da forskerne fjernede CARP3-genet ved hjælp af gensplejsning, ændrede sammensætningen af de enzymer (adenylatcyklaser), der producerer cAMP ved flagelspidsen. "Trypanosomer var efterfølgende ikke længere i stand til effektivt at kolonisere tsetse-fluer," forklarer videnskabsmanden. "I spytkirtlerne fandt vi ikke en eneste celle af parasitterne længere."
Fra grundforskning til anvendelse:Målet med en langsigtet strategi kunne være at forringe interaktionerne mellem CARP3 og adenylatcyklaser. Dette kunne for eksempel gøres ved hjælp af et syntetisk peptid, der ville blive produceret i fluerne ved hjælp af teknikken kendt som paratransgenese. Uden at kolonisere spytkirtlerne fra tsetsefluer ville trypanosomerne ikke længere blive overført. + Udforsk yderligere
Hvordan Nagana bæres af tsetse-fluer
 Varme artikler
Varme artikler
-
 Offentlige ressourcer øger opdagelsen af lægemidler og giver indsigt i proteinfunktionenKredit:CC0 Public Domain Forskere ved Broad Institute of MIT og Harvard har taget Connectivity Map-en meget udbredt ressource af værktøjer og data-til nye højder med en massivt opskaleret version.
Offentlige ressourcer øger opdagelsen af lægemidler og giver indsigt i proteinfunktionenKredit:CC0 Public Domain Forskere ved Broad Institute of MIT og Harvard har taget Connectivity Map-en meget udbredt ressource af værktøjer og data-til nye højder med en massivt opskaleret version. -
 Hvordan biologer gør feltarbejde sikrere og mere retfærdigtKredit:Unsplash/CC0 Public Domain Forestil dig at sidde fast i tætte omgivelser med dine kolleger 24 timer i døgnet, langt væk fra dit hjem, under forhold, der er stressende og ukendte. Forskere ha
Hvordan biologer gør feltarbejde sikrere og mere retfærdigtKredit:Unsplash/CC0 Public Domain Forestil dig at sidde fast i tætte omgivelser med dine kolleger 24 timer i døgnet, langt væk fra dit hjem, under forhold, der er stressende og ukendte. Forskere ha -
 Hvad er valmuer?Ifølge legenden, den græske gudinde for frugtbarhed og landbrug, Demeter, elsker valmuer - og hvorfor ikke? Valmue blomster vokser let fra frø, har brug for lidt vand og pleje, og bringe farve og jube
Hvad er valmuer?Ifølge legenden, den græske gudinde for frugtbarhed og landbrug, Demeter, elsker valmuer - og hvorfor ikke? Valmue blomster vokser let fra frø, har brug for lidt vand og pleje, og bringe farve og jube -
 Forskere afslører, hvordan SARS-CoV-2 blokerer antiviralt forsvarBillede af den ultrastrukturelle morfologi udstillet af 2019 Novel Coronavirus (2019-nCoV) (CDC). Kredit:CDC/ Alissa Eckert, MS; Dan Higgins, MAM / Public domain Forskere ved Francis Crick Institut
Forskere afslører, hvordan SARS-CoV-2 blokerer antiviralt forsvarBillede af den ultrastrukturelle morfologi udstillet af 2019 Novel Coronavirus (2019-nCoV) (CDC). Kredit:CDC/ Alissa Eckert, MS; Dan Higgins, MAM / Public domain Forskere ved Francis Crick Institut
- Vulkanforurening vender tilbage forbundet med spring i tilfælde af luftvejssygdomme
- Forsyningskunder overvurderer omkostningsbesparelser med energispareplaner
- Sanktionsramte Huawei planlægger komponentfabrik i Europa
- Uber viser et tab på 1 mia. USD i 1. kvartal på stigende omsætning
- GPM-satellitsonder gennembløder storme i det sydlige Texas og Golfen
- Shell siger, at fortjenesten springer på høje energipriser


