Lysaktiveret antitumorlægemiddel kan inspirere til nye kræftbehandlinger, der har minimale bivirkninger
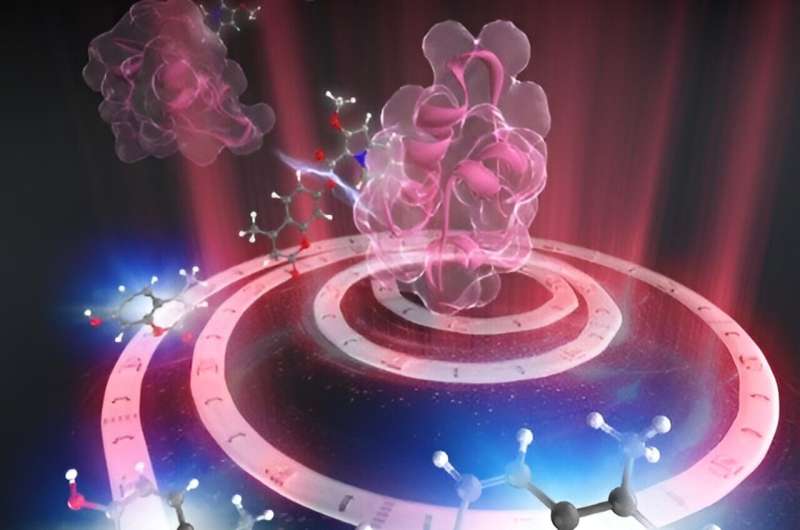
RIKEN-kemikere har demonstreret et guld-nanocluster-system, der bærer to komponenter af et lægemiddel i et kontrolleret forhold for maksimal kræftcelledræbende effekt. Det aktive lægemiddel forbliver sikkert maskeret, indtil rødt lys udløser dets frigivelse, hvilket minimerer sideskader på raske celler i nærheden af tumoren. Undersøgelsen er publiceret i Chemical Science .
En lovende måde at behandle kræft på er at bruge lys til at aktivere anticancer-lægemidler inde i tumorer i kroppen, siger Kenji Watanabe fra RIKEN Center for Biosystems Dynamics Research. Dette bør reducere uønskede bivirkninger, da lyset kun skinner på tumoren og skåner raske celler i nærheden.
Watanabe og hans medarbejdere har udviklet potentielle kræftlægemidler maskeret af kemiske grupper kaldet indoliziner. Når det udsættes for rødt lys i nærværelse af et andet molekyle kaldet en fotosensibilisator, nedbrydes indolizinet for at frigive det aktive lægemiddel.
Men da holdet først testede konceptet i celler, gjorde de relativt lave koncentrationer af indolizin- og fotosensibilisatorkomponenterne i hver celle det vanskeligt effektivt at udløse frigivelsen af lægemidlet ved hjælp af lys.
"Vi søgte derfor et bæresystem til at bringe disse to komponenter sammen," siger Watanabe. "Det fik os til at udforske guld nanoklynger."
Holdet planlagde at bruge dedikerede kemiske forbindelsesgrupper til at fastgøre indolizin- og fotosensibilisatorkomponenterne til overfladerne af guldnanoklyngerne.
De skulle dog overvinde to udfordringer. Konventionelle syntesemetoder genererer guld-nanoklynger med en ukontrolleret blanding af de to forbindende grupper på tværs af deres overflade, hvilket skæver forholdet mellem de to komponenter, de bærer. De involverer også relativt barske forhold, der kan være skadelige for en af de forbindende grupper.
Holdet overvandt begge udfordringer ved at kombinere de to kemiske forbindende grupper i en enkelt kemisk enhed, og derefter udvikle en mild metode til at fastgøre den til overfladerne af guld nanoclusters. "Denne strategi gjorde det muligt for os at realisere en ensartet fordeling af begge forbindende grupper på partikeloverfladen," siger Watanabe.
Når først det indolizin-maskerede anticancerlægemiddel og fotosensibilisatoren var vedhæftet, viste de resulterende guldnanocluster ubetydelig toksicitet for celler i mørke. "Men efter bestråling med rødt lys viste nanoclusteren betydelig toksicitet mod kræftceller," siger Watanabe.
"Dette arbejde giver et lovende grundlag for at udvikle nye kræftbehandlingsmidler," tilføjer han.
Holdet planlægger at udvide guldnanoclusternes multifunktionelle karakter ved at tilføje målrettede grupper, der selektivt binder sig til kræftceller, og derved øge nanoclusteroptagelsen i tumoren og samtidig minimere optagelsen og associerede bivirkninger i raske celler.
Flere oplysninger: Kenji Watanabe et al., Klikbare bisreaktive små guld-nanoklynger til fremstilling af multifunktionaliserede nanomaterialer:Anvendelse til photouncaging af et anticancer-molekyle, Chemical Science (2023). DOI:10.1039/D3SC04365G
Journaloplysninger: Kemisk videnskab
Leveret af RIKEN
 Varme artikler
Varme artikler
-
 Sammenligning af effektiviteten af camouflage hos forskellige dyrKredit:Pixabay/CC0 Public Domain En kvartet af forskere fra Universidade Estadual de Campinas, Básicas, Universidade de São Paulo og São Bernardo do Campo, alle i Brasilien, har gennemført en under
Sammenligning af effektiviteten af camouflage hos forskellige dyrKredit:Pixabay/CC0 Public Domain En kvartet af forskere fra Universidade Estadual de Campinas, Básicas, Universidade de São Paulo og São Bernardo do Campo, alle i Brasilien, har gennemført en under -
 Ny forskning viser, hvordan man kan inkludere flere landmænd i udformningen af nye miljøpolitikk…Kredit:Bobby Mikul/public domain Et papir udgivet i People and Nature undersøger, hvordan regeringens politiske beslutningstagere kan inkludere en bred vifte af landmænd i udformningen af nye Env
Ny forskning viser, hvordan man kan inkludere flere landmænd i udformningen af nye miljøpolitikk…Kredit:Bobby Mikul/public domain Et papir udgivet i People and Nature undersøger, hvordan regeringens politiske beslutningstagere kan inkludere en bred vifte af landmænd i udformningen af nye Env -
 Coyoter i New York City behøver ikke at stole på menneskefødeKredit:Unsplash/CC0 Public Domain Forskere i New York City har analyseret DNAet af byprærieulve og opdaget, at prærieulvene spiser en række indfødte byttearter og supplerer denne diæt med fødevarer
Coyoter i New York City behøver ikke at stole på menneskefødeKredit:Unsplash/CC0 Public Domain Forskere i New York City har analyseret DNAet af byprærieulve og opdaget, at prærieulvene spiser en række indfødte byttearter og supplerer denne diæt med fødevarer -
 Hvordan superbugs bruger spejlbilleder til at skabe antibiotikaresistensEt farvet scanningselektronmikrografi af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Methicillin-resistente Staphylococcus aureus (MRSA) er en bakteriel infektion, der er ble
Hvordan superbugs bruger spejlbilleder til at skabe antibiotikaresistensEt farvet scanningselektronmikrografi af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Methicillin-resistente Staphylococcus aureus (MRSA) er en bakteriel infektion, der er ble
- Et forældreparadoks for sorte piger i retssystemet
- 3D-modeller hjælper videnskabsmænd med at måle oversvømmelser
- Den uretfærdighed, som uddannelse gør mod miljøet:En historie fra en overlevende
- Nyt tidligt varslingssystem for naturbrande kunne forhindre forårsflammer
- Når aluminium overstråler guld:Undersøg detaljer om aluminiums værdifulde plasmoniske egenskaber
- NASAs første mission til de trojanske asteroider integrerer sit andet videnskabelige instrument


