Avanceret analyse afslører, hvordan forskellige lægemidler interagerer med det samme mål
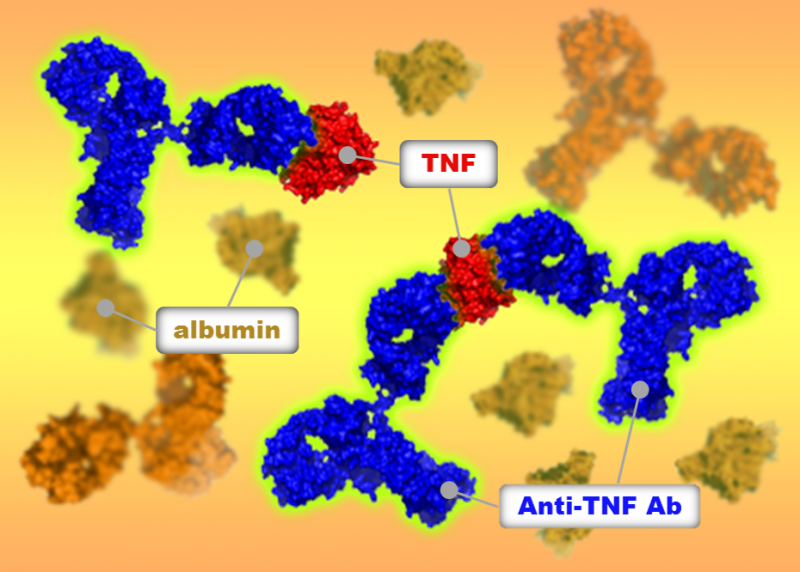
Figur 1:Fluorescens-detekterede analytiske ultracentrifugeringsanalyser afslørede, at TNF-antagonister dannede forskellige komplekser med TNF i humant serum. Kredit:Osaka University
Osaka University-ledede forskere identificerede forskelle i, hvordan tre lægemidler binder til tumornekrosefaktor, en vigtig mediator af inflammatorisk sygdom. Holdet brugte sedimentationshastighed analytisk ultracentrifugering til at undersøge lægemiddel-mål binding i et fysiologisk miljø og ved klinisk relevante koncentrationer. De afslørede forskelle mellem de tre lægemidler i størrelsen og strukturen af de dannede komplekser, hvilket kan forklare forskelle i lægemidlernes kliniske effekt. Denne teknik kan hjælpe med at optimere fremtidens lægemiddeldesign.
Tumornekrosefaktor (TNF) er involveret i en række inflammatoriske sygdomme, herunder leddegigt og psoriasisgigt, ankyloserende spondylitis, og psoriasis. Adskillige lægemidler rettet mod TNF er tilgængelige til behandling af disse tilstande; imidlertid, på trods af at handle på samme mål, deres kliniske effektivitet og bivirkninger er forskellige.
Nu, et hold ledet af forskere ved Osaka University har afsløret forskelle i størrelsen af lægemiddel-TNF-komplekser dannet af tre anti-TNF-lægemidler, og forholdet mellem lægemiddelmolekyler og TNF-molekyler i disse komplekser. Forskerne brugte en teknik kaldet sedimentationshastighed analytisk ultracentrifugering (SV AUC), som går ud på at dreje en opløsning ved meget høje hastigheder og undersøge, hvor hurtigt centrifugalkraften får molekyler til at bevæge sig gennem opløsningen. Ud fra disse oplysninger, holdet kunne regne ud størrelsen og formen af TNF-lægemiddelkomplekserne. Undersøgelsen blev offentliggjort i mAbs.
"Tidligere undersøgelser har undersøgt TNF-binding med lægemiddelmolekyler, " siger hovedforfatter Elena Krayukhina. "Men, begrænsninger af de anvendte teknikker har begrænset forskere til at se på disse interaktioner i meget enkle løsninger, eller med molekylerne i relativt høje koncentrationer. Ved at bruge SV AUC og fluorescensdetektion, vi var for første gang i stand til at overveje TNF-lægemiddelkompleksdannelse i det komplekse miljø af humant plasma, og ved koncentrationer, der afspejler faktiske kliniske forhold."

Figur 2:Repræsentative rå fluorescens-detekterede analytiske ultracentrifugeringsdata erhvervet i humant serum (A) og respektive sedimentationskoefficientfordeling afledt af dataanalyse (B). Kredit:Osaka University
Størrelsen af de komplekser, lægemidler danner med deres mål, er vigtig, fordi den påvirker, hvordan kroppen reagerer på lægemidlet. Forskning tyder på, at større komplekser fjernes fra kroppen hurtigere end mindre. Større komplekser er også mere tilbøjelige til at få kroppen til at starte et immunrespons mod lægemidlet, identificere og dermed angribe det som en ekstern trussel. Dette kan reducere lægemidlets kliniske effektivitet. Forskerne fandt ud af, at et af de tre testede lægemidler, etanercept, dannede de mindste komplekser med TNF og udløste ikke en signalvej involveret i immunrespons, i modsætning til de to andre stoffer.
"Disse resultater giver indsigt i mulige mekanismer, der ligger til grund for observerede forskelle i klinisk effektivitet og sikkerhed af disse tre anti-TNF-lægemidler, " siger den tilsvarende forfatter Susumu Uchiyama. "Vores resultater indikerer også, at SV AUC er et værdifuldt værktøj til at undersøge, hvordan lægemidler binder til deres mål, som vil hjælpe med at forudsige terapeutisk virkning og optimere farmaceutisk design i fremtiden."
Sidste artikelHydrogenbindinger opdaget direkte for første gang
Næste artikelEt bedre bæredygtigt hygiejnebind
 Varme artikler
Varme artikler
-
 Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af
Moderne alkymi skaber selvlysende jernmolekylerKredit:Lunds Universitet En gruppe forskere ved Lunds Universitet i Sverige har lavet det første jernbaserede molekyle, der er i stand til at udsende lys. Dette kunne bidrage til udviklingen af -
 Ny membran kunne bane vej for billigt, effektivt fremstillede biobrændstofferDe forskellige typer biobrændstofmembraner. Kredit:Imperial College London Forskere har udviklet en omkostningseffektiv metode til udvinding af biobrændstof, som kan gøre dem til levedygtige alter
Ny membran kunne bane vej for billigt, effektivt fremstillede biobrændstofferDe forskellige typer biobrændstofmembraner. Kredit:Imperial College London Forskere har udviklet en omkostningseffektiv metode til udvinding af biobrændstof, som kan gøre dem til levedygtige alter -
 Forskere sætter AI i gang med at lave kemiforudsigelserKredit:Caltech Efterhånden som kemien er blevet mere avanceret og de kemiske reaktioner mere komplekse, det er ikke længere altid praktisk for forskere at sætte sig ved en laboratoriebænk og begyn
Forskere sætter AI i gang med at lave kemiforudsigelserKredit:Caltech Efterhånden som kemien er blevet mere avanceret og de kemiske reaktioner mere komplekse, det er ikke længere altid praktisk for forskere at sætte sig ved en laboratoriebænk og begyn -
 Høst energi fra lys ved hjælp af bioinspirerede kunstige cellerPlasmoniske kunstige celler dannes ved selvsamling af Au-Ag nanoroder i hule rum. Kredit:Billede med tilladelse fra Wiley-VCH (Angew. Chem. Int. Ed., 58, 4896 (2019)). Forskere designede og forban
Høst energi fra lys ved hjælp af bioinspirerede kunstige cellerPlasmoniske kunstige celler dannes ved selvsamling af Au-Ag nanoroder i hule rum. Kredit:Billede med tilladelse fra Wiley-VCH (Angew. Chem. Int. Ed., 58, 4896 (2019)). Forskere designede og forban
- Spildevandsløsninger med øje for landbruget i Ghana
- Hvordan kan nogen holde sig vågen i 11 dage?
- Startups, old-line bilproducenter sigter mod at tage bid af Tesla
- Langtidsvirkende injicerbar medicin som potentiel vej til COVID-19-terapi
- Maddikeanalyse går molekylært til retsmedicinske sager
- Robat bruger lyd til at navigere og kortlægge et nyt miljø


