Forskere undersøger proteiner, der forårsager hjernesygdomme på atomniveau
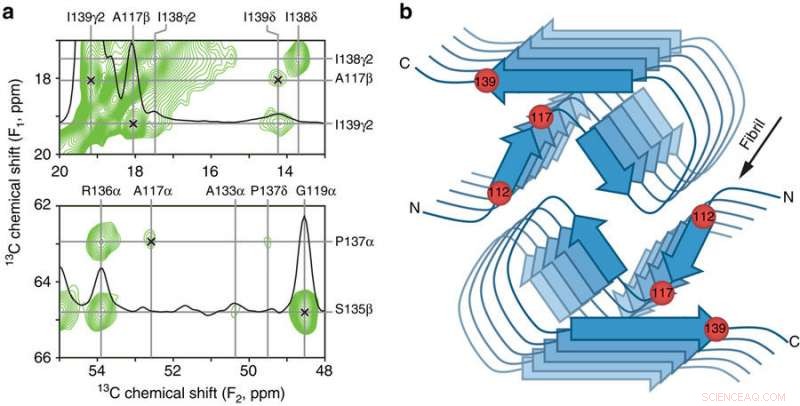
Nøgleinterresidue kontakter og skematisk model af den humane PrP23-144 amyloid β-kerne. a Små områder af et 900 MHz todimensionalt 13C-13C DARR faststof-NMR-spektrum registreret med en blandingstid på 500 ms for amyloidfibriller genereret fra huPrP23-144 udtrykt med 3-13C-pyruvat som carbonkilde. De spektrale områder indeholder de vigtigste begrænsninger på [hu] amyloid kernestrukturen i form af utvetydige langrækkende korrelationer (angivet med x-mærker) mellem følgende 13C atomer:A117Cβ-I139Cγ2, A117Cβ-I139Cδ, A117Ca-P137Ca, og G119Ca-S135Cβ. b Skematisk model for [hu] amyloidkernen baseret på kombinationen af solid-state NMR og tilted-beam transmissionselektronmikroskopidata (se tekst for detaljer). I denne model består [hu] amyloidfibriller af to protofilamenter i et C2-symmetrisk arrangement med β-arkområder, der løber parallelt med den lange fibrilakse. De omtrentlige placeringer af aminosyrerest 112, 117, og 139, som har stor indflydelse på strukturen vedtaget af PrP23-144 amyloid som diskuteret i teksten, er angivet med røde kugler. Kredit: Naturkommunikation (2017). DOI:10.1038/s41467-017-00794-z
Forskere, der studerer et protein, der forårsager en arvelig degenerativ hjernesygdom hos mennesker, har opdaget, at mennesket, mus og hamster former af proteinet, som har næsten identiske aminosyresekvenser, udviser distinkte tredimensionelle strukturer på atomniveau.
Proteinet forårsager familiær human cerebral amyloid angiopati (CAA), og studiet, som optræder i Naturkommunikation , er den første til at undersøge former for proteinet i tre forskellige arter.
Christopher Jaroniec, professor i kemi og biokemi ved Ohio State University, sagde, at resultaterne fremhæver det faktum, at mindre ændringer i enkelte aminosyrer kan forårsage dybe forskelle i struktur og funktion blandt denne familie af proteiner.
"De store forskelle i disse proteiners strukturer og transmissionskarakteristika - forårsaget af hvad der svarer til tilsyneladende ubetydelige forskelle i positionerne af nogle få kulstof- og brintatomer - er ret bemærkelsesværdige, "Sagde Jaroniec.
Studiet danner ikke grundlag for en ny test eller behandling for CAA, men snarere bruger disse proteiner som modeller til at forstå de grundlæggende aspekter af overførsel på tværs af arter af en hel klasse af degenerative hjernesygdomme kendt som prionsygdomme, forklarede han. Det understreger også nytten af solid-state nuklear magnetisk resonans (NMR) spektroskopi til billeddannelse af strukturerne af proteiner forbundet med prionsygdomme.
Forskere ved, at i kroppen, proteinmolekylerne forbundet med CAA danner plaques, der sætter sig fast i blodkarvæggene i hjernen, men der har ikke været detaljerede undersøgelser af disse plaques molekylære struktur før for nylig. I 2008, Ohio State forskere og deres partnere ved Case Western Reserve University udførte de indledende solid-state studier af den relevante prionproteinvariant, og indsnævrede listen over muligvis kritiske aminosyrer for dens funktion til omkring 30.
Nu, de har vist, at en enkelt aminosyre - kendt på sit antal langs proteinkæden, 139-er nøglen til, at denne prionproteinvariant vedtager en "menneskelignende" kontra en "hamsterlignende" struktur, mens en anden aminosyre, 112, styrer de strukturelle forskelle mellem den menneskelige og museversion af proteinet. De har også vist, at disse to aminosyrer ser ud til at være ansvarlige for fremkomsten af strukturelt adskilte "prionstammer" inden for den samme proteinsekvens, i analogi med særskilte stammer af en virus.
De mest kendte prionsygdomme omfatter bovin spongiform encephalopati (ofte kaldet "kogalskab") og Creutzfeldt-Jakobs sygdom hos mennesker. Alle er uhelbredelige og dødelige, og nogle kan også overføres. De strukturer, der er vedtaget af hjernens prionproteiner i plaques, menes at være afgørende for deres evne til at blive overført mellem forskellige værter og forårsage sygdom.
"Vores gruppe arbejder i øjeblikket på at bestemme de højopløselige molekylære strukturer af de trunkerede prionproteinvarianter forbundet med familiær human CAA for at opnå en fuldstændig atomistisk forståelse af de faktorer, der ligger til grund for deres overførsel, og denne undersøgelse er et vigtigt trædesten i denne indsats, " sagde Jaroniec.
"Vi håber, at vores gruppe og andre forskere en dag vil være i stand til at bruge lignende metoder til at opklare det strukturelle grundlag for de overførbare prionsygdomme, " han tilføjede.
 Varme artikler
Varme artikler
-
 Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h -
 Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn
Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn -
 Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal
Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal -
 Infrarød sensor som ny metode til opdagelse af lægemidlerDen infrarøde sensor blev udviklet af Klaus Gerwert (til venstre) og Jörn Güldenhaupt. Kredit:Gerd Kock Ved hjælp af en infrarød sensor, biofysikere ved Ruhr-Universität Bochum (RUB) er lykkedes h
Infrarød sensor som ny metode til opdagelse af lægemidlerDen infrarøde sensor blev udviklet af Klaus Gerwert (til venstre) og Jörn Güldenhaupt. Kredit:Gerd Kock Ved hjælp af en infrarød sensor, biofysikere ved Ruhr-Universität Bochum (RUB) er lykkedes h
- Hvorfor skal vi lave flere forsøg med et eksperiment?
- 3-D atomstruktur af TRPML1 ionkanal offentliggjort
- Højere koncentrationer af gadelygter garanterer ikke sikkerhed:undersøgelse
- Hvorfor får dæmoner skylden for søvnlammelse?
- Tag 2 til SpaceXs første astronautopsendelse med flere storme
- Sådan fungerer afsaltning


