Hvad er bly iv-oxid og en svovlsyreopløsning til at producere en elektrisk strøm. Reaktionsprodukterne er ii sulfat i vand?
Reaktanter:
* Bly(IV)oxid (PbO2)
* Svovlsyre (H2SO4)
Produkter:
* Bly(II)sulfat (PbSO4)
* Vand (H2O)
* Iltgas (O2)
Elektrokemisk reaktion:
Den overordnede elektrokemiske reaktion for denne proces er:
PbO2(s) + 2H2SO4(aq) → PbSO4(s) + 2H2O(l) + O2(g)
I denne reaktion reduceres bly(IV)oxid til bly(II)sulfat, mens svovlsyre oxideres til vand og oxygengas. Reduktionen af bly(IV)oxid sker ved katoden, mens oxidationen af svovlsyre sker ved anoden.
Elektrodereaktioner:
* Katode (reduktion):PbO2(s) + 4H+ (aq) + 2e- → PbSO4(s) + 2H2O(l)
* Anode (Oxidation):2H2SO4(aq) → O2(g) + 2H2O(l) + 2SO42-(aq)
Elektrisk strøm:
Strømmen af elektroner fra anoden til katoden gennem det eksterne kredsløb genererer en elektrisk strøm. Denne strøm kan bruges til at drive forskellige elektriske enheder.
Applikationer:
Denne elektrokemiske reaktion anvendes i bly-syre-batterier, som almindeligvis anvendes i biler og andre køretøjer. I disse batterier bruges bly(IV)oxid som den positive elektrode (katode), mens svovlsyre bruges som elektrolyt. Reaktionen mellem disse komponenter producerer en elektrisk strøm og genererer vand og oxygengas som biprodukter.
Sidste artikelHvad er prikken og krydset af methanol?
Næste artikelHvad er den kemiske formel for kobbermat?
 Varme artikler
Varme artikler
-
 Denne hydrogeltablet kan rense en liter flodvand på en timeBrug af hydrogel-tabletten til at rense vand kræver ingen energitilførsel og skaber ikke skadelige biprodukter. Kredit:University of Texas i Austin. Så meget som en tredjedel af verdens befolkning
Denne hydrogeltablet kan rense en liter flodvand på en timeBrug af hydrogel-tabletten til at rense vand kræver ingen energitilførsel og skaber ikke skadelige biprodukter. Kredit:University of Texas i Austin. Så meget som en tredjedel af verdens befolkning -
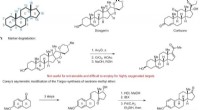 Strømlinet proces åbner lægemiddeludvikling til en ny klasse af steroiderIntroduktion til steroidstruktur og syntese. en, Det generelle steroid tetracykliske skelet. b, Eksempler på naturlige steroider. c, Udvalgte metoder til steroidsyntese ved hjælp af semisyntetiske og
Strømlinet proces åbner lægemiddeludvikling til en ny klasse af steroiderIntroduktion til steroidstruktur og syntese. en, Det generelle steroid tetracykliske skelet. b, Eksempler på naturlige steroider. c, Udvalgte metoder til steroidsyntese ved hjælp af semisyntetiske og -
 Team udvikler peptid, der gør lægemiddelresistente bakterier følsomme over for antibiotika igenDen forbedrede styrke af det antimikrobielle peptid, når det bruges sammen med antibiotika, giver håb for udsigten til en kombinationsbehandlingsstrategi til at tackle visse antibiotika-tolerante infe
Team udvikler peptid, der gør lægemiddelresistente bakterier følsomme over for antibiotika igenDen forbedrede styrke af det antimikrobielle peptid, når det bruges sammen med antibiotika, giver håb for udsigten til en kombinationsbehandlingsstrategi til at tackle visse antibiotika-tolerante infe -
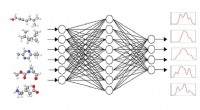 Beregning af fingeraftryk af molekyler med kunstig intelligensDet grafiske neurale netværk GNN modtager små molekyler som input med den opgave at bestemme deres spektrale responser. Ved at matche dem med de kendte spektre lærer GNN-programmet at beregne spektre
Beregning af fingeraftryk af molekyler med kunstig intelligensDet grafiske neurale netværk GNN modtager små molekyler som input med den opgave at bestemme deres spektrale responser. Ved at matche dem med de kendte spektre lærer GNN-programmet at beregne spektre
- Hvad bruger kloroplaster til at gøre glukose?
- Lille titaniumbarriere stopper stort problem i brændstofproducerende solceller
- Kan Twitter hjælpe med katastrofeberedskab? Ny forskning undersøger hvordan
- Højtydende SERS-substrat foreslået baseret på 2H-TaS2 og enkeltatomlags guldklynger
- Journalistjob er usikre, økonomisk usikker og kræver familiestøtte
- Reimagining MRI-kontrast:Jern overgår gadolinium


