Hvad er formlen for ionforbindelse dannet af magnesium- og phosphoratomer?
Magnesium (Mg) har et atomnummer på 12, og dets elektroniske konfiguration er 2, 8, 2. Det betyder, at magnesium har to valenselektroner i sin yderste skal. For at opnå en stabil konfiguration har magnesium tendens til at miste disse to elektroner, hvilket resulterer i en positiv ladning på 2+ (Mg²⁺).
Fosfor (P) har et atomnummer på 15, og dets elektroniske konfiguration er 2, 8, 5. Fosfor har fem valenselektroner i sin yderste skal. For at opnå en stabil konfiguration har fosfor tendens til at få tre elektroner, hvilket resulterer i en negativ ladning på 3- (P³⁻).
Når magnesium- og fosforatomer samles for at danne en ionisk forbindelse, tiltrækker de positivt ladede magnesiumioner (Mg²⁺) og de negativt ladede fosforioner (P3⁻) hinanden på grund af elektrostatiske kræfter. For at opretholde elektrisk neutralitet skal forholdet mellem magnesium og fosforioner i forbindelsen være sådan, at magnesiumionernes samlede positive ladning er lig med fosforionernes samlede negative ladning.
Det enkleste forhold mellem magnesium og fosforioner, der opnår denne elektriske neutralitet, er 3:2. Det betyder, at for hver tre magnesiumioner (3Mg²⁺) er der to fosforioner (2P3⁻). Formlen for den ioniske forbindelse dannet af magnesium- og phosphoratomer er derfor Mg3P2.
Sammenfattende er formlen for den ioniske forbindelse dannet af magnesium- og phosphoratomer Mg3P2, som repræsenterer tre magnesiumioner (Mg²+) kombineret med to fosforioner (P3⁻) for at opnå elektrisk neutralitet.
 Varme artikler
Varme artikler
-
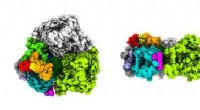 Unikke pigmenter i fotosyntetiske marinebakterier afslører, hvordan den lever i svagt lysFigur 1:Et kryo-elektronmikroskopi tæthedskort over Acaryochloris marina fotosystem I afslører strukturelle elementer, der gør det muligt for det at omdanne lavenergilys til kemisk energi. Kredit:Æn
Unikke pigmenter i fotosyntetiske marinebakterier afslører, hvordan den lever i svagt lysFigur 1:Et kryo-elektronmikroskopi tæthedskort over Acaryochloris marina fotosystem I afslører strukturelle elementer, der gør det muligt for det at omdanne lavenergilys til kemisk energi. Kredit:Æn -
 Ny bioink bringer 3D-print af menneskelige organer tættere på virkelighedenKarakterisering af rECM hybrid hydrogeler. a) Billede af alginat og mus rECM hydrogeler. Målestænger:1 mm. b) Alginat – fluorescein- og ECM – rhodamin -modificeret rECM -hydrogel, der viser fordelinge
Ny bioink bringer 3D-print af menneskelige organer tættere på virkelighedenKarakterisering af rECM hybrid hydrogeler. a) Billede af alginat og mus rECM hydrogeler. Målestænger:1 mm. b) Alginat – fluorescein- og ECM – rhodamin -modificeret rECM -hydrogel, der viser fordelinge -
 Nyt koncept til at identificere kemiske kombinationer med potentielle sundhedseffekterKredit:CC0 Public Domain Omkring 350, 000 kemikalier er registreret på verdensplan. Nogle af disse kan bidrage til menneskers eksponering for stoffer og blandinger via produkter, applikationer ell
Nyt koncept til at identificere kemiske kombinationer med potentielle sundhedseffekterKredit:CC0 Public Domain Omkring 350, 000 kemikalier er registreret på verdensplan. Nogle af disse kan bidrage til menneskers eksponering for stoffer og blandinger via produkter, applikationer ell -
 At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
At se nærmere på genetiske skift i kræftEn krystalstruktur af en del af menneskelig DPF2, et protein, der styrer en genetisk switch, der fortæller blodstamceller, hvornår de skal blive røde og hvide blodlegemer. Orange og gule områder illus
- Kranier viser, at New World blev afgjort to gange:undersøgelse
- Spotlight på umærkelige effekter af nanopartikler
- Med Uber Eats hurtig vækst kommer potentiale for profit
- Forskning udforsker sammenhængen mellem politisk engagement og lovlighed
- Udvidet virkelighed af høj kvalitet i brugervenlige og billige enheder
- De fleste voksne har aldrig hørt om TikTok. Det er ved design


