Var det nødvendigt at tilsætte svovlsyre i denne titrering?
1. Stærkt syrekrav :Svovlsyre er en stærk syre, hvilket betyder, at den dissocierer fuldstændigt i vand og frigiver hydrogenioner (H+). I syre-base titreringer bruges en stærk syre typisk som titrant, fordi den giver en konsistent og nøjagtig kilde til H+ ioner.
2. Protonation af basen :I dette tilfælde er analytten, der titreres, sandsynligvis en svag base. Når en svag base reagerer med en stærk syre, donerer syren H+ ioner til basen, hvilket resulterer i dannelsen af dens konjugerede syre. Protoneringen af basen er et afgørende trin i titreringsprocessen.
3. Endepunktsbestemmelse :Slutpunktet for en syre-base titrering er det punkt, hvor mol H+ ioner tilsat fra titranten er støkiometrisk ækvivalente med mol af den svage base, der er til stede i analytopløsningen. Svovlsyre, som er en stærk syre, gør det muligt at observere et skarpt og tydeligt endepunkt, hvilket gør det lettere at bestemme ækvivalenspunktet nøjagtigt.
4. pH-kontrol :Tilsætning af svovlsyre hjælper med at kontrollere opløsningens pH under titreringen. Når den stærke syre tilsættes, sænker den opløsningens pH, hvilket skaber et surt miljø, der er velegnet til protonering af den svage base.
5. Almindelig ioneffekt :I nogle tilfælde kan svovlsyre også bruges til at skabe en fælles ioneffekt. Hvis den svage base, der titreres, har en konjugeret syre, der er en svag syre, kan tilsætningen af en stærk syre som svovlsyre undertrykke ioniseringen af den konjugerede syre og dermed flytte ligevægten mod dannelsen af en mere svag base. Dette kan forbedre nøjagtigheden af titreringen ved at minimere konkurrerende ligevægte.
Derfor er tilsætningen af svovlsyre i titreringen essentiel for at protonere den svage base, give en stærk og konsistent kilde til H+ ioner, lette bestemmelsen af endepunktet, kontrollere opløsningens pH og potentielt påvirke ioniseringsligevægten af svag base og dens konjugerede syre.
Sidste artikelCarboxylsyrer er moderat stærkere end 2-naphthol?
Næste artikelHvor mange kemiske grundstoffer har du i dit periodiske system?
 Varme artikler
Varme artikler
-
 Lille molekyle transporterer jern i mus, menneskelige celler til behandling af visse former for anæ…Kredit:Pixabay/CC0 Public Domain Et naturligt lille molekyle afledt af et cyprestræ kan transportere jern i levende mus og menneskeceller, der mangler det protein, der normalt gør arbejdet, hvilket
Lille molekyle transporterer jern i mus, menneskelige celler til behandling af visse former for anæ…Kredit:Pixabay/CC0 Public Domain Et naturligt lille molekyle afledt af et cyprestræ kan transportere jern i levende mus og menneskeceller, der mangler det protein, der normalt gør arbejdet, hvilket -
 Havforurening:Hvordan fortyndes plasttilsætningsstoffer i vand, og hvor risikable er de?Plastaffald kan forurene vandforsyningen, da det nedbrydes til mikroplast, og dets tilsætningsstoffer udvaskes. Disse tilsætningsstoffer indeholder nogle gange skadelige kemikalier, som ophobes i milj
Havforurening:Hvordan fortyndes plasttilsætningsstoffer i vand, og hvor risikable er de?Plastaffald kan forurene vandforsyningen, da det nedbrydes til mikroplast, og dets tilsætningsstoffer udvaskes. Disse tilsætningsstoffer indeholder nogle gange skadelige kemikalier, som ophobes i milj -
 Forskere afslører virkningsmekanisme for lovende kræftforbindelseUNC Linebergers Lee M. Graves, PhD. Kredit:University of North Carolina ved Chapel Hill School of Medicine Forskere fra University of North Carolina Lineberger Comprehensive Cancer Center har afsl
Forskere afslører virkningsmekanisme for lovende kræftforbindelseUNC Linebergers Lee M. Graves, PhD. Kredit:University of North Carolina ved Chapel Hill School of Medicine Forskere fra University of North Carolina Lineberger Comprehensive Cancer Center har afsl -
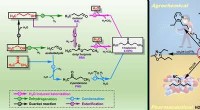 Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
Forskere fremmer biomassetransformationsprocessen(A) Dette er en foreslået reaktionsvej, der fører til 4-HPO. (B) Dette er 4-HPO-udnyttelse. Kredit:DICP Biomasse kan tjene som en vedvarende kilde til både energi og kulstof. Acetone, n-butanol, o
- Hvad er en aritmetisk sekvens?
- Kan vi bruge en stærk opløsning af NaOH til at lave natriumekstrakt i stedet for metal?
- Forskerhold dokumenterer ny opdagelse af dinosaur-slægtning
- Undersøgelse rehabiliterer klimamodeller
- Mikrober, der forårsager huller, kan danne superorganismer, der kan kravle og spredes på tænderne
- Sådan beregnes området af en hexagon


