Hvilke elementer er mest sandsynligt at opgive elektroner i stedet for at dele elektroner?
Her er hvorfor:
* Lav elektronegativitet: Disse elementer har lav elektronegativitet, hvilket betyder, at de har en svag attraktion for elektroner. Dette gør dem villige til at miste elektroner for at opnå en stabil elektronkonfiguration.
* en eller to valenselektroner: De har kun en eller to valenselektroner i deres yderste skal. At miste disse elektroner giver dem mulighed for at opnå en stabil, ædelgaskonfiguration.
Eksempel:
* natrium (NA) Har en valenselektron. Den mister let denne elektron til dannelse af en +1 ion (Na +), hvilket opnås den stabile elektronkonfiguration af neon (NE).
Mens deling af elektroner er en almindelig måde for elementer at opnå stabilitet på, er elementer i gruppe 1 og 2 mere tilbøjelige til at miste elektroner til at danne kationer snarere end at dele elektroner til dannelse af kovalente bindinger.
Sidste artikelHvad er gummiforbindelse?
Næste artikelHvor mange protoner neutroner og elektroner er i kulstof 6?
 Varme artikler
Varme artikler
-
 Grøn metode kunne gøre det muligt for hospitaler at producere brintoverilte i husetForskernes H-celle setup til udvikling af deres hydrogenperoxidproduktionsmetode. Kredit:University of California - San Diego Et team af forskere har udviklet en bærbar, mere miljøvenlig metode ti
Grøn metode kunne gøre det muligt for hospitaler at producere brintoverilte i husetForskernes H-celle setup til udvikling af deres hydrogenperoxidproduktionsmetode. Kredit:University of California - San Diego Et team af forskere har udviklet en bærbar, mere miljøvenlig metode ti -
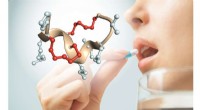 Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer
Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer -
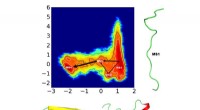 Ny metode fremskynder simuleringer, giver ny indsigt i proteinfoldningForskere søger at forstå proteinfoldning bedre for at helbrede fejlfoldningssygdomme, men denne utroligt komplekse proces kræver sofistikerede algoritmer til at identificere foldemekanismerne. Beregni
Ny metode fremskynder simuleringer, giver ny indsigt i proteinfoldningForskere søger at forstå proteinfoldning bedre for at helbrede fejlfoldningssygdomme, men denne utroligt komplekse proces kræver sofistikerede algoritmer til at identificere foldemekanismerne. Beregni -
 Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af
Effektivitetsspring ved adskillelse af para-xylen ved hjælp af nye kulstofmembranerGeorgia Tech brugte disse kulstofmembranmaterialer til at adskille para-xylen fra o-xylen. Kredit:Christopher Moore, Georgia Tech Benzinindustrien erkender vigtigheden af para-xylen, på grund af
- Regulering af todimensionelle nanomaterialer til lithium-ion-batterier
- Truende Florida, orkanen Ian nærmer sig katastrofal kategori 5
- Forudsiger kort over fare for jordskælv større rystelser, end der faktisk fandt sted? Forskning fi…
- Kunne en neandertaler meditere?
- Hvorfor du kan lugte regn
- Ny undersøgelse udfordrer den fremherskende teori om, hvordan dybhavsventiler koloniseres


