Hvilke elementer vil forekomme som diatomiske molekyler og kan ikke eksistere individuelle atomer?
* hydrogen (h 2 )
* nitrogen (n 2 )
* ilt (O 2 )
* fluor (f 2 )
* klor (cl 2 )
* brom (br 2 )
* jod (i 2 )
Disse elementer er mere stabile som diatomiske molekyler på grund af de stærke kovalente bindinger, de danner med sig selv. Disse bindinger dannes ved at dele elektroner mellem to atomer af det samme element, hvilket resulterer i en mere stabil elektronkonfiguration.
Det er vigtigt at huske, at disse elementer ikke er de * kun * elementer, der kan danne diatomiske molekyler, bare dem, der ofte findes som diatomiske molekyler i naturen.
Sidste artikelHvordan er organiske og uorganiske molekyler både?
Næste artikelHvilken type stof er ledende, når det opløses i vand?
 Varme artikler
Varme artikler
-
 Team bruger 3D-print til at optimere gennemstrømningselektroder til elektrokemiske reaktorerFor første gang, Lawrence Livermore National Laboratory-ingeniører har 3D-printede carbonflow-elektroder (FTEer)-porøse elektroder, der er ansvarlige for reaktionerne i reaktorerne-fra grafen-aerogele
Team bruger 3D-print til at optimere gennemstrømningselektroder til elektrokemiske reaktorerFor første gang, Lawrence Livermore National Laboratory-ingeniører har 3D-printede carbonflow-elektroder (FTEer)-porøse elektroder, der er ansvarlige for reaktionerne i reaktorerne-fra grafen-aerogele -
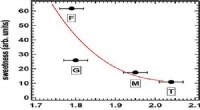 Vand kan være nøglen til at forstå sødmeKredit:American Chemical Society Et tranebær, honning eller en slikbar - hvad smager sødest? Disse fødevarer indeholder sukkerarter, som mennesker kan opfatte forskelligt. Et tranebær virker syrli
Vand kan være nøglen til at forstå sødmeKredit:American Chemical Society Et tranebær, honning eller en slikbar - hvad smager sødest? Disse fødevarer indeholder sukkerarter, som mennesker kan opfatte forskelligt. Et tranebær virker syrli -
 Chemputer lover app-styret revolution for lægemiddelproduktionEt billede af en kemputerobot. Kredit:Cronin Group, Kemiskolen, Glasgow En radikal ny metode til fremstilling af lægemiddelmolekyler, som bruger blueprints, der kan downloades, til let og pålideli
Chemputer lover app-styret revolution for lægemiddelproduktionEt billede af en kemputerobot. Kredit:Cronin Group, Kemiskolen, Glasgow En radikal ny metode til fremstilling af lægemiddelmolekyler, som bruger blueprints, der kan downloades, til let og pålideli -
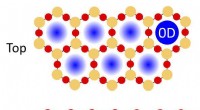 Dækning af metalkatalysatoroverflader med tynde todimensionale oxidmaterialer kan forbedre kemiske …En illustration af fysisk lukkede rum i en porøs dobbeltlags silica film på en metalkatalysator, der kan bruges til kemiske reaktioner. Siliciumatomer er angivet med de orange cirkler; iltatomer ved d
Dækning af metalkatalysatoroverflader med tynde todimensionale oxidmaterialer kan forbedre kemiske …En illustration af fysisk lukkede rum i en porøs dobbeltlags silica film på en metalkatalysator, der kan bruges til kemiske reaktioner. Siliciumatomer er angivet med de orange cirkler; iltatomer ved d
- Forskere modellerer nøjagtigt virkningen af aerosoler på skyer
- Hvad ville det indikere, når en given bjergkæde ikke blev dannet ved subduktion?
- At spille godt på arbejdet kan koste dig succes
- Hvor mange elektron kan det andet energiniveau have?
- Den onde cirkel af høj akademisk præstation
- Endnu et sonisk boom natten over muligt fra SpaceX opsendelse af månebundet lander


