Hvorfor fremstiller klor en ionisk forbindelse med brom?
* Lignende elektronegativitet: Klor og brom er begge halogener og har meget ens elektronegativitetsværdier. Dette betyder, at de har en lignende tendens til at tiltrække elektroner. Forskellen i elektronegativitet mellem dem er ikke signifikant nok til at skabe en komplet overførsel af elektroner, hvilket er nødvendigt til ionisk bindingsdannelse.
* kovalent binding: I stedet for en ionisk binding danner klor og brom A kovalent binding . Dette betyder, at de deler elektroner for at opnå en stabil elektronkonfiguration. Den resulterende forbindelse er et diatomisk molekyle kaldet brommonochlorid (BRCL) .
Nøglepunkter:
* Ioniske bindinger forekommer mellem elementer med signifikant forskellige elektronegativitetsværdier (normalt metaller og ikke-metaller).
* Kovalente bindinger forekommer mellem elementer med lignende elektronegativitetsværdier (normalt ikke-metaler).
Kortfattet: Chlor og brom, der er begge halogener, har lignende elektronegativiteter og danner derfor en kovalent binding, ikke en ionisk binding.
Sidste artikelHvorfor er natriumhydroxid en stærk base?
Næste artikelEr diethylether polær eller ikke -polær?
 Varme artikler
Varme artikler
-
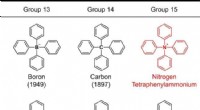 Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd
Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd -
 Er emballage af gurkemeje film fremtiden for supermarkedernes hylder?Kredit:pinkomelet/123rf Forskere i Malaysia har udviklet en biopolymerfilm, der indeholder gurkemejeolie, der stopper væksten af en almindelig madsvamp og nedbrydes godt i jorden. Filmen kan giv
Er emballage af gurkemeje film fremtiden for supermarkedernes hylder?Kredit:pinkomelet/123rf Forskere i Malaysia har udviklet en biopolymerfilm, der indeholder gurkemejeolie, der stopper væksten af en almindelig madsvamp og nedbrydes godt i jorden. Filmen kan giv -
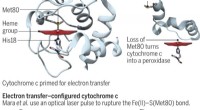 Energetiske omkostninger ved den entatiske tilstand af cytochrom c kvantificeretEn ændring i det aktive steds konformation gør cytochrom c fra en elektronshuttle i respiration til et peroxidaseenzym til apoptose. Kredit:(c) Videnskab 23. juni 2017:Vol. 356, Udgave 6344, s. 1236
Energetiske omkostninger ved den entatiske tilstand af cytochrom c kvantificeretEn ændring i det aktive steds konformation gør cytochrom c fra en elektronshuttle i respiration til et peroxidaseenzym til apoptose. Kredit:(c) Videnskab 23. juni 2017:Vol. 356, Udgave 6344, s. 1236 -
 Molekyleundersøgelser afslører potentiel behandling for patienter med slagtilfældeEn tegneserierepræsentation afsløret af undersøgelsen viser den lukkede tilstand af PDZ-domænerne. Kredit: Naturkommunikation , doi:10.1038/s41467-018-06133-0 I en forlængelse af forskning offent
Molekyleundersøgelser afslører potentiel behandling for patienter med slagtilfældeEn tegneserierepræsentation afsløret af undersøgelsen viser den lukkede tilstand af PDZ-domænerne. Kredit: Naturkommunikation , doi:10.1038/s41467-018-06133-0 I en forlængelse af forskning offent
- Hvordan er Salt Smeltis?
- Det sted, som Darwin besøgte på sine ture rundt om i verden, havde den største indflydelsesmangel…
- Opbygning af værktøjer i ChatGPT-stil med jordobservation
- Forældede holdninger risikerer at øge ulighederne på hybridarbejdspladser, tænketanken advarer
- Hvad bager der på Saturns måne Titan?
- 25-minutters test kunne forenkle indledende diagnose af urinvejsinfektioner, bekæmpe antibiotikares…


